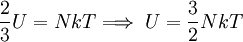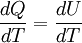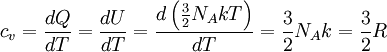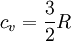Conocimientos adicionales recomendados
Primer principio de la termodinámicaLa energía interna de un sistema se refiere a la energía cinética aleatoria de traslación, rotación o vibración que puedan poseer sus átomos o moléculas, además de la energía potencial de interacción entre estas partículas. Cuando se permite que fluya calor a un sistema como resultado de una diferencia de temperatura entre el sistema y sus alrededores, ocurrirá un aumento equivalente en la energía interna siempre que no se permita al sistema realizar trabajo mecánico sobre sus alrededores. En general, esto no sucede así, y se tiene que: El aumento en la energía interna del sistema más la cantidad del trabajo externo efectuado por el mismo, equivale al calor absorbido por el sistema. Esta observación constituye el Primer principio de la termodinámica, que en general expresa la conservación de la energía y se puede expresar matemáticamente como: donde :
Consideremos un sistema formado por un cuerpo caliente y un cuerpo frío en contacto térmico. Primero consideremos solo el cuerpo caliente, puesto que no efectúa trabajo, se tiene: donde ΔQ es la cantidad de calor entregada por el cuerpo caliente hacia el cuerpo frío, haciendo que la energía interna disminuya, por lo que también ΔU es negativo. Ahora consideremos el cuerpo frío, y puesto que tampoco efectúa trabajo, se obtiene: donde ΔQ' es el calor absorbido por el cuerpo frío, por lo tanto es positivo, y ΔU' es la energía interna del cuerpo frío, la que aumenta debido al aumento de temperatura, luego ΔU' es positivo. Por último consideremos el sistema completo, es decir ambos cuerpos en contacto térmico. Ya que no hay flujo de calor desde los alrededores, para este sistema se tiene: lo que concuerda con lo dicho anteriormente. Esto expresa simplemente que la cantidad de energía térmica que sale del objeto caliente, es igual a la que fluje hacia el objeto frío. Análogamente, se obtiene: lo que indica que el aumento en la energía interna del cuerpo que inicialmente estaba más frío, es igual a la disminución de la energía interna del cuerpo que estaba más caliente al principio. En el estado final del sistema combinado, no hay diferencia de temperatura, por lo que no hay flujo de calor, es decir se llegó al equilibrio térmico: Observaciones:
La energía interna como función de la temperaturaLa energía interna total de un gas, puede expresarse como la energía cinética total de todas las moléculas, que se puede describir igualmente como el número total de moléculas multiplicado por su energía cinética media, es decir:
Las componentes de la velocidad v, es decir vx,vy,vz, están relacionadas con la velocidad v de la partícula mediante: Obteniendo el promedio en ambos miembros para todas las partículas, se tiene: Sin embargo, como el movimiento de aquellas moléculas es aleatorio, no hay nada que distinga entre sí a las componentes x, y y z, por lo tanto:
Por medio de un cálculo avanzado que no se expondrá aquí, se obtiene: siendo Luego, se puede escribir:
Reemplazando (2) en (3):
Pero de acuerdo a (1):
Reemplazando (5) en (4) :
Ahora, por la ecuación de estado de los gases ideales se tiene: Dividiendo ambos miembros de la igualdad por N, para obtener el número de Avogadro: Sea Reemplazando este último valor de R en la ecuación de estado:
Por último, reemplazando (6) en (7) se obtiene: Esta última igualdad nos indica que la energía interna de un gas ideal, depende sólo de la temperatura, ya que N y k son constantes para el gas. Calor molar a volumen constanteSupongamos que se encierra en un recipiente rígido, 1 mol de gas que contiene NA moléculas, de manera que su volumen permanece constante, por lo que no se podrá expandir y no efectuará trabajo alguno sobre sus alrededores. Si el gas absorbe una cantidad de calor dQ a través de las paredes del recipiente, entonces por la Primera ley de la termodinámica se tiene, ya que no se efectúa trabajo:
Dividiendo ambos miembros de la igualdad por dT se obtiene: Se define el calor específico molar a volumen constante denotado por cv como: Por lo tanto se obtiene una importante relación para el calor molar a volumen constante: Trabajo de expansiónCuando un gas se expande puede efectuar trabajo sobre sus alrededores, y de igual forma, para comprimir un gas a volumen más pequeño, se debe efectuar trabajo externo sobre él. La cantidad real de trabajo efectuado en estos procesos no sólo depende de la ecuación de estado del gas, sino también de las condiciones en las que ocurre la expansión o la compresión, es decir, de que se realice a temperatura constante, o a presión constante, o sin flujo de calor, o de alguna otra manera. Los principales procesos mediante los cuales puede alterarse el estado térmico de un gas, son: Véase también:
Categoría: Termodinámica |
|
| Este articulo se basa en el articulo Calor_y_trabajo publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




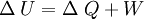
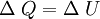
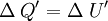
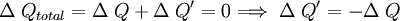
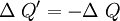
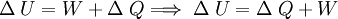 , es decir;
, es decir; 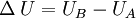 significa que el sistema sufre un proceso o transformación de A a B.
significa que el sistema sufre un proceso o transformación de A a B.
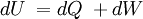
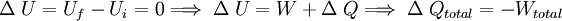
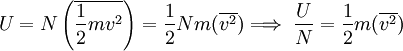 ..........(1)
..........(1)
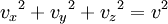
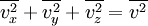
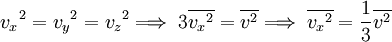 ..........(2)
..........(2)
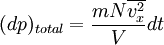
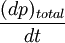 la fuerza sobre un área unitaria,
la fuerza sobre un área unitaria, 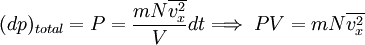 ..........(3)
..........(3)
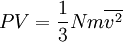 ..........(4)
..........(4)
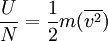 entonces
entonces 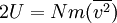 ..........(5)
..........(5)
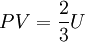 ..........(6)
..........(6)
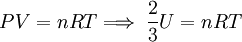
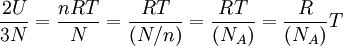
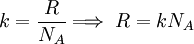 donde k es la
donde k es la 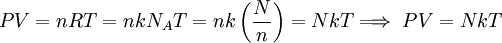 ..........(7)
..........(7)