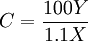El carbono-13 (13C) es un isótopo estable natural del carbono y uno de los isótopos ambientales, ya que forma parte del 1,1 % de todo el carbono natural de la Tierra. Conocimientos adicionales recomendadosDetección por espectroscopía NMRDebido a sus propiedades de los spines nucleares, con un spin de +1/2, justo como el átomo de hidrógeno, este isótopo responde a una señal resonante de radiofrecuencia (RF). La absorción y emisión de la señal RF por los núcleos atómicos puede monitorearse y detectarse usando espectroscopía de resonancia magnética nuclear, más conocida como espectroscopía NMR. Esta es una técnica que da información de la identidad y número de átomos adyacentes a otros átomos en dicha molécula, dando la agrupación de la estructura de una molécula orgánica. Desde que 12C tiene "spin cero", no da una señal NMR, y solo el 1% de los átomos en una molécula son 13C, no es querido que el acoplamiento carbono-carbono se vea. Para la adquisición del espectro NMR 13C puede tardar de unos minutos a horas debido a muchos escanes para lograr resultados distinguibles del ruido de fondo. En las proteínas NMR biológica se puede deliberadamente marcar con 13C (y usualmente nitrógeno-15) para facilitar la determinación de la estructura de las proteínas. Esto es activado por crecimiento de microorganismos geneticamente modificados para expresar la proteína en un medio de crecimiento con glucosa marcada con 13C como única fuente de carbono. En esta vía, las proteínas con un contenido de 13C del 100% pueden producirse. Detección por espectroscopía de masasUn espectograma de masa de un compuesto orgánico usualmente contendrá un pequeño pico de una unidad de masa más grande que el aparente pico molecualr del ión (M). Esto se conoce como el pico M+1 y se origina debido a la presencia de átomos 13C. Una molécula conteniendo un átomo de carbono se esperará que tenga un pico M+1 de approximadamente 1,1% del tamaño del pico M como ese 1,1% de átomos de carbono serán 13C más que 12C. Similarmente una molécula con dos átomos de carbono tendrá un pico M+1 de aproximadamente 2,2% del tamaño del pico M, siendo doble por la completa probabilidad que la molécula contenga un átomo 13C. En lo de arriba se han simplificado la matemática y la química, sin embargo puede usarse efectivamente para dar el número de átomos de carbono de moléculas de tamaño pequeño a mediano. En la siguiente fórmula, el resultado debería redondearse al integral más cercano:
Los compuestos enriquecidos 13C se usan en estudios de procesos metabólicos por medio de la espectroscopía de masa. Tales compuestos son seguros debidoa a su no radioactividad. Además, 13C se usa para cunatificar proteínas (proteómica cuantitativa). Otra importante aplicación es marcar isótopos estables con aminoácidos en cultivo de células (acrónimo en inglés:SILAC). Véase también
|
||||||||||||||||||||
| Este articulo se basa en el articulo Carbono-13 publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | ||||||||||||||||||||


Enciclopedia