|
El cloruro de amonio o cloruro amónico es una sal de amonio cuya fórmula química es NH4Cl. La síntesis de cloruro amónico se produce a partir de vapores de cloruro de hidrógeno y de amoniaco. 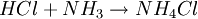 Conocimientos adicionales recomendados
Propiedades físicasEn estado sólido la coloración varía entre incoloro y blanco. Es inodoro e higroscópico en diversas formas. Su punto de sublimación es de 350°C. Su densidad relativa (agua = 1) es 1,5. La presión de vapor que genera es de 0.13 kPa a 160°C. Su masa molecular es de: 53.49 g/mol. Solubilidad en agua
Peligros químicosLa sustancia se descompone al calentarla intensamente o al arder, produciendo humos tóxicos e irritantes de óxidos de nitrógeno, amoníaco y cloruro de hidrógeno. La disolución en agua es un ácido débil. Reacciona violentamente con nitrato amónico y clorato potásico, originando peligro de incendio y explosión. Reacciona con concentrados de ácidos para formar cloruro de hidrógeno y bases fuertes para formar amoníaco. Reacciona con sales de plata para formar compuestos sensibles al choque. Ataca al cobre y compuestos. Límites de exposiciónTLV (como TWA): 10 mg/m³ (humos) (ACGIH 1995-1996). TLV (como STEL): 20 mg/m³ (humos) (ACGIH 1995-1996). MAK no establecido. Vías de exposiciónLa sustancia se puede absorber por inhalación del polvo o humo y por ingestión. Es muy tóxica. AlmacenamientoSe almacena separado de: nitrato amónico, clorato potásico, ácidos, álcalis, sales de plata. Se recomienda mantenerlo en un lugar seco. Categoría: Cloruros |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Cloruro_amónico publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Enciclopedia




