|
En física, el diamagnetismo es una propiedad de los materiales que consiste en ser repelidos por los imanes. Es lo opuesto a los materiales ferromagnéticos los cuales son atraidos por los imanes. El fenómeno del diamagnetismo fue descubierto y nominado por primera vez en septiembre de 1845 por Michael Faraday cuando vio un trozo de bismuto que era repelido por un polo cualquiera de un imán; lo que indica que el campo externo del imán induce un dipolo magnético en el bismuto de sentido opuesto. Conocimientos adicionales recomendados
DefiniciónSe refiere al cambio en momento dipolar electrónico en presencia de un campo externo. Los momentos dipolares se oponen al campo aplicado, reduciendo el valor de éste con respecto al del espacio libre, aunque sólo en una pequeña fracción. Todos los átomos tienen electrones "orbitándolos", por lo que podemos afirmar que todos los materiales son diamagnéticos, pero hay otros efectos que dominan sobre el diamagnetismo en la mayoría de los materiales. Por ejemplo, es más fácil orientar un momento dipolar de espín que una órbita, y en átomos con número impar de electrones, el paramagnetismo domina. Pero en átomos con número par de electrones las contribuciones del momento dipolar del espín del electrón en una y otra dirección se cancelan casi totalmente (del principio de exclusión de Pauli sabemos que el espín de electrones con los tres primeros números cuánticos iguales debe ser contrario), y el momento dipolar dominante es el orbital o electrónico. Generalmente, el diamagnetismo se justifica por la circulación de los electrones en los orbitales doblemente ocupados. Como en un cable de un material conductor, la circulación de los electrones se produce en el sentido en el que el campo magnético que generan se opone al campo aplicado, generando una repulsión (ley de Lenz). Por este mismo mecanismo, los superconductores presentan un diamagnetismo extraordinariamente alto. El diamagnetismo es por tanto dominante en materiales constituidos por átomos o moléculas con número par de electrones. En ausencia del campo, los momentos dipolares de espín se orientan azarosamente y estadísticamente se cancelan casi totalmente, y el átomo (o molécula) tiene un momento dipolar neto igual a cero. A nivel macroscópico, las fluctaciones de los dipolos individuales por efectos de temperatura se promedia estadísticamente para dar un momento dipolar neto nulo. Al aplicar un campo externo, el cambio en momento dipolar magnético es muy pequeño (del orden de una parte en cien mil), y aunque el cambio se opone al campo, el efecto no es muy importante. Materiales Diamagnéticos
Los materiales diamagnéticos más comunes son: bismuto metálico, hidrógeno, helio y los demás gases nobles, cloruro de sodio, cobre, oro, silicio, germanio, grafito, bronce y azufre. Nótese de esta lista que no todos tienen número par de electrones. El grafito pirolítico, que tiene un diamagnetismo especialmente alto, se ha usado como demostración visual, ya que una capa fina de este material levita (por repulsión) sobre un campo magnético lo suficientemente intenso (a temperatura ambiente). Experimentalmente, se verifica que los materiales diamagnéticos tienen una permeabilidad magnética inferior a la unidad, y una susceptibilidad magnética negativa, prácticamente independiente de la temperatura, y generalmente del orden (en unidades cegesimales) de En los materiales diamagneticos, el flujo magnético disminuye y en los paramagneticos el flujo magnético aumenta Referencias
Véase tambiénEnlaces externos
Categoría: Magnetoquímica |
|
| Este articulo se basa en el articulo Diamagnetismo publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




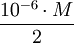 e.m.u./mol, donde M es la
e.m.u./mol, donde M es la 