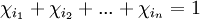|
La fracción molar es una unidad química para expresar la concentración de soluto en una disolución. Nos expresa la proporción en que se encuentran los moles de soluto con respecto a los moles totales de disolución, que se calculan sumando los moles de soluto(s) y de disolvente. Para calcular la fracción molar de una mezcla homogénea, se emplea la siguiente expresión: 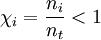 Conocimientos adicionales recomendadosDonde ni es el número de moles del soluto, y nt el número total de moles en toda la disolución (tanto de solutos como de disolvente). Como el volumen de una disolución depende de la temperatura y de la presión; cuando éstas cambian, el volumen cambia con ellas. Gracias a que la fracción molar no está en función del volumen, es independiente de la temperatura y la presión. Además cabe notar que en los gases ideales la variación del volumen será proporcional para cada uno de los solutos, y por lo tanto también para la solución. De esta manera hay una relación directa entre las fracciones molares y los volúmenes parciales.
Por ejemplo, en una mezcla binaria de 6 moles de etanol y 4 moles de agua, lo que da un total de 10 moles, la fracción molar del etanol es de 6/10 = 0,6; mientras que la fracción molar del agua es 4/10 = 0,4. Todas las fracciones molares de una disolución serán siempre menores que 1, y la suma de éstas dará como resultado 1. Referencias
|
|
| Este articulo se basa en el articulo Fracción_molar publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia