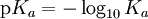|
pKa es parecido al pH, es la fuerza que tienen las moléculas de disociarse (es el logaritmo negativo de la constante de disociación de un ácido débil). Conocimientos adicionales recomendadosUna forma conveniente de expresar la relativa fortaleza de un ácido es mediante el valor de su pKa, que permite ver de una manera sencilla en cambios pequeños de pKa los cambios asociados a variaciones grandes de Ka. Valores pequeños de pKa equivalen a valores grandes de Ka (constante de disociación) y, a medida que el pKa decrece, la fortaleza del ácido aumenta. Constantes de disociación en algunos ácidos:
Un ácido será más fuerte cuanto menor es su PKa y en una base pasa al reves, que es más fuerte cuanto mayor es su PKa. Esas constantes de disociación no son fijas, dependen de otras variables Categoría: Química |
| Este articulo se basa en el articulo PKa publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia