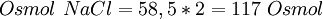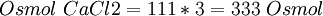|
La presión osmótica es una propiedad coligativa y es una de las principales características que deben tener en cuenta en las relaciones de los líquidos intersticiales e intravasculares que constituyen el medio interno. La membrana celular determina un comportamiento que contiene soluciones de distinta concentración al medio extracelular que la rodea, creando una barrera de control de solutos. Conocimientos adicionales recomendadosCuando una solución se pone en contacto con el solvente a través de una membrana semipermeable que deja pasar a las moléculas de solvente pero no las de soluto, las moléculas de solvente, que están en mayor concentración en el disolvente puro, difunden hacia la solución, donde su concentración es más pequeña. Se puede llegar a una situación de equilibrio contrarrestando esa tendencia mediante la aplicación de una cierta fuerza sobre la disolución, aumentando la presión (aplicación de fuerza en una determinada área, lo que se conoce como presión osmótica de la solución y representada con la letra griega Π. Al aumentar la presión osmótica, es posible detener el flujo de solvente (en general agua) a través de la membrana semipermeable en incluso revertirlo (hacer pasar solvente desde la solución al solvente puro, por ejemplo, transformando agua con algún soluto en agua pura). Al considerar como semipermeable a la membrana plasmática, las células de los organismos pluricelulares deben permanecer en equilibrio osmótico con los líquidos tisulares. Esta viene dada en osmoles. Para calcular la osmolaridad de una solución se debe multiplicar el peso molecular de ésta por la cantidad de elementos en los que la misma se disocia. Ejemplos: 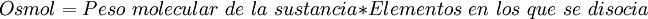 En el caso del cloruro sódico (NaCl) en una concentración de 1 mol%:
Para el CaCl2 en una concentración de 1 mol%:
Véase también |
| Este articulo se basa en el articulo Presión_osmótica publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia