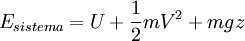|
La primera ley de la termodinámica o Primer Principio de la termodinámica es una aplicación de la ley universal de conservación de la energía a la termodinámica y, a su vez, identifica el calor como una transferencia de energía. Uno de los enunciados de la primera ley de la termodinámica es el siguiente: El incremento de la energía interna de un sistema termodinámico es igual a la diferencia entre la cantidad de calor transferida a un sistema y el trabajo realizado por el sistema a sus alrededores.
En su forma matemática más sencilla se puede escribir para cualquier volumen de control: donde ΔU es el incremento de energía interna del sistema, Q es el calor cedido al sistema, y W es el trabajo cedido por el sistema a sus alrededores. Véase también: Criterio de signos termodinámico
El primer principio de la termodinámica es una ley empírica que no puede demostrarse teóricamente. Conocimientos adicionales recomendados
DescripciónLa forma de transferencia de energía común para todas las ramas de la física y ampliamente estudiada por éstas, es el trabajo. Dependiendo de la delimitación de los sistemas a estudiar y del enfoque considerado, el trabajo puede ser caracterizado como mecánico, eléctrico, etc. pero su característica principal es el hecho de transmitir energía y que, en general, la cantidad de energía transferida no depende solamente de los estados inicales y finales, sino también de la forma concreta en la que se lleven a cabo los procesos. El calor es la forma de transferencia de un tipo de energía particular, propiamente termodinámica, que es debida únicamente a que los sistemas se encuentren a distintas temperaturas (es algo común en la termodinámica catalogar el trabajo como toda trasferencia de energía que no sea en forma de calor). Los hechos experimentales corroboran que este tipo de transferencia también depende del proceso y no sólo de los estados inicial y final. Sin embargo, lo que los experimentos sí demuestran es que dado cualquier proceso de cualquier tipo que lleve al sistema de un estado A a otro B, la suma de la energía transferida en forma de trabajo y la energía transferida en forma de calor siempre es la misma. Es decir, que la variación de energía interna del sistema es independiente del proceso que la lleve de un estado a otro. En forma de ecuación y teniendo en cuenta el criterio de signos termodinámico esta ley queda de la forma: Así, el Primer Principio relaciona magnitudes de proceso (dependientes de éste) como son el trabajo y el calor, con una variable de estado (independiente del proceso) tal como lo es la energía interna. Aplicaciones de la Primera Ley
Un sistema cerrado es uno que no tiene entrada ni salida de masa, también es conocido como masa de control. El sistema cerrado tiene interacciones de trabajo y calor con sus alrededores, así como puede realizar trabajo de frontera. La ecuación general para un sistema cerrado (despreciando energía cinética y potencial) es: Donde Q es la cantidad total de transferencia de calor hacia o desde el sistema (positiva cuando entra al sistema y negativa cuando sale de éste), W es el trabajo total (negativo cuando entra al sistema y positivo cuando sale de éste) e incluye trabajo eléctrico, mecánico y de frontera; y U es la energía interna del sistema.
Un sistema abierto es aquel que tiene entrada y/o salida de masa, así como interacciones de trabajo y calor con sus alrededores, también puede realizar trabajo de frontera. La ecuación general para un sistema abierto es: 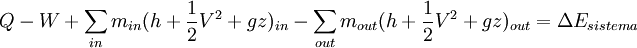 O igualmente:
Donde in representa todas las entradas de masa al sistema; out representa todas las salidas de masa desde el sistema; y θ es la energía por unidad de masa del flujo y comprende entalpía, energía potencial y energía cinética, La energía del sistema es
El balance de energía se simplifica considerablemente para sistemas en estado estacionario (también conocido como estado estable). En estado estacionario se tiene ΔEsistema = 0, por lo que el balance de energía queda: 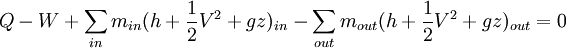
Es aquel sistema en el cual no hay intercambio ni de masa ni de energía con el exterior. Véase tambiénEnlaces externos
Categoría: Termodinámica |
|||||||||||
| Este articulo se basa en el articulo Primera_ley_de_la_termodinámica publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia

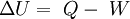



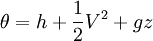 .
.