|
El principio de exclusión de Pauli es un principio cuántico enunciado por Wolfgang Ernst Pauli en 1925 que establece que no puede haber dos fermiones con todos sus números cuánticos idénticos (esto es, en el mismo estado cuántico de partícula individual). Hoy en día no tiene el estatus de principio, ya que es derivable de supuestos más generales (de hecho es una consecuencia del Teorema de la estadística del spin). DesarrolloConocimientos adicionales recomendadosEl principio de exclusión de Pauli sólo se aplica a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. Son fermiones, por ejemplo, los protones, los neutrones, y los electrones, los tres tipos de partículas subatómicas que constituyen la materia ordinaria. El principio de exclusión de Pauli rige, así pues, muchas de las características distintivas de la materia. En cambio, partículas como el fotón y el (hipotético) gravitón no obedecen a este principio, ya que son bosones, esto es, forman estados cuánticos simétricos y tienen espín entero. Como consecuencia, una multitud de fotones puede estar en un mismo estado cuántico de partícula, como en los láseres. "Un átomo no existe con los mismos números cuánticos". Es sencillo derivar el principio de Pauli, basándonos en el artículo de partículas idénticas. Los fermiones de la misma especie forman estados totalmente antisimétricas, lo que para el caso de dos partículas significa que: (La permutación de una partícula por otra invierte el signo de la función que describe al sistema). Si las dos partículas ocupan el mismo estado cuántico |ψ>, el estado del sistema completo es |ψψ>. Entonces, así que el estado no puede darse. Esto se puede generalizar al caso de más de dos partículas. ConsecuenciasEl principio de exclusión de Pauli interpreta un papel importante en un vasto número de fenómenos físicos. Uno de los más importantes es la configuración electrónica de los átomos. Un átomo eléctricamente neutro aloja a un número de electrones igual al número de protones en su núcleo. Como los electrones son fermiones, el principio de exclusión les prohíbe ocupar el mismo estado cuántico, así que tienen que ir ocupando sucesivas capas electrónicas. Como ejemplo, es ilustrativo considerar un átomo neutro de helio, que tiene dos electrones ligados. Estos dos electrones pueden ocupar los estados de mínima energía (1s), si presentan diferente espín. Esto no viola el principio de Pauli, porque el espín es parte del estado cuántico del electrón, así que los dos electrones están ocupando diferentes estados cuánticos (espínorbitales). Sin embargo, el espín sólo puede tomar dos valores propios diferentes (o, dicho de otra forma, la función que describe al sistema sólo puede tener dos estados diferentes que sean propios del operador espín El principio de Pauli también es responsable de la estabilidad a gran escala de la materia. Las moléculas no pueden aproximarse arbitrariamente entre sí, porque los electrones ligados a cada molécula no pueden entrar en el mismo estado que los electrones de las moléculas vecinas. Este es el principio que hay tras el término de repulsión r-12 en el Potencial de Lennard-Jones. Enunciado en palabras llanas, pero didácticas: En la astronomía se encuentran algunas de las demostraciones más espectaculares de este efecto, en la forma de enanas blancas y estrellas de neutrones. En ambos objetos, las estructuras atómicas usuales han sido destruidas por la acción de fuerzas gravitacionales muy intensas. Sus constituyentes sólo se sustentan por la "presión de degeneración" (que les prohíbe estar en un mismo estado cuántico). Este estado exótico de la materia se conoce como materia degenerada. En las enanas blancas, los átomos se mantienen apartados por la presión de degeneración de los electrones. En las estrellas de neutrones, que presentan fuerzas gravitacionales aún mayores, los electrones se han fusionado con los protones para producir neutrones, que tienen una presión de degeneración mayor. Otro fenómeno físico del que es responsable el principio de Pauli es el ferromagnetismo, en el que el principio de exclusión implica una energía de intercambio que induce al alineamiento paralelo de electrones vecinos (que clásicamente se alinearían antiparalelamente). Véase también |
| Este articulo se basa en el articulo Principio_de_exclusión_de_Pauli publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




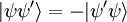
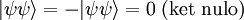
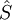 ). En un átomo de
). En un átomo de 