|
En el modelo atómico de Bohr de la estructura del átomo, desarrollado por Niels Bohr en 1913, los electrones giran alrededor de un núcleo central. En este modelo los electrones orbitan sólo a determinadas distancias del núcleo, dependiendo de su energía. En el átomo más simple, el hidrógeno, solamente orbita un electrón, siendo la orbita de menor radio o radio de Bohr, la correspondiente a la situación de menor energía. Conocimientos adicionales recomendadosDe acuerdo con los datos de 2006 CODATA [1], el radio de Bohr del hidrógeno vale 5.291 772 0859(36)×10−11 m (es decir, approximadamente 52.9 pm or 0.529 ångströms). El número entre paréntesis (36) representa la incertidumbre de los últimos dígitos. Este valor se puede obtener de la relación entre el Bohr y otras constantes físicas (que se obtiene cuando n = 1 en la cuarta hipótesis de los postulados de Bohr) y representa la unidad atómica de longitud
Véase también |
| Este articulo se basa en el articulo Radio_de_Bohr publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




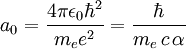
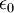 es la permitividad del vacío
es la permitividad del vacío
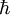 es la
es la 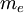 es la
es la 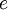 es la carga elemental
es la carga elemental
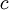 es la
es la 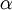 es la
es la 