|
En geometría y cristalografía las Redes de Bravais son una disposición infinita de puntos discretos cuya estructura es invariante bajo traslaciones. En la mayoría de casos también se da una invariancia bajo rotaciones o simetría rotacional.Estas propiedades hacen que desde todos los nodos de una red de Bravais se tenga la misma perspectiva de la red. Se dice entonces que los puntos de una red de Bravais son equivalentes. Mediante teoría de grupos se ha demostrado que solo existe una única red de bravais unidimensional, 5 redes bidimensionales y 14 modelos distintos de redes tridimensionales. La red unidimensional es elemental siendo ésta una simple secuencia de nodos equidistantes entre sí. En dos o tres dimensiones las cosas se complican más y la variabilidad de formas obliga a definir ciertas estructuras patrón para trabajar cómodamente con las redes. Para generar estas normalmente se usa el concepto de celda primitiva. Las celdas unitarias, son paralelogramos (2D) o paralelepípedos (3D) que constituyen la menor subdivisión de una red cristalina que conserva las características generales de toda la retícula, de modo que por simple traslación de la misma, puede reconstruirse la red al completo en cualquier punto. Una red típica R en donde {a1,..., an} es una base en el espacio Rn. Puede haber diferentes bases que generen la misma red pero el valor absoluto del determinante de los vectores ai vendrá siempre determinado por la red por lo que se lo puede representar como d(R). Conocimientos adicionales recomendados
Características de las celdas unitarias y las celdas convencionalesLas celdas unitarias se pueden definir de forma muy simple a partir de dos (2D) o tres vectores (3D). La construcción de la celda se realiza trazando las paralelas de estos vectores desde sus extremos hasta el punto en el que se cruzan. Existe un tipo de celda unitaria que se construye de un modo distinto y que presenta ciertas ventajas en la visualización de la red ya que posee la misma simetría que la red, es la celda de Wigner-Seitz. Una celda unitaria se caracteriza principalmente por contener un único nodo de la red de ahí el adjetivo de "unitaria". Si bien en muchos casos existen distintas formas para las celdas unitarias de una determinada red el volumen de toda celda unitaria es siempre el mismo. En ocasiones resulta más sencillo construir otro tipo de celdas que sin ser unitarias describen mejor la estructura de la red que tratamos. Este tipo de celdas se denominan celdas convencionales. Éstas tienen, a su vez, sus propios parámetros de red y un volumen determinado. Todas estas celdas se consideran celdas primitivas ya que son capaces de cubrir todo el espacio mediante traslaciones sin que queden huecos ni solapamientos. Empaquetamiento compacto: Esto es cuando los átomos de la celda están en contacto unos con otros. No siempre será así y en muchos casos mediará una distancia mínima entre las nubes electrónicas de los diferentes átomos. Parámetro de red: Es la longitud de los lados de la celda unitaria. Puede haber tan solo uno, dos o hasta tres parámetros de red distintos dependiendo del tipo de red de bravais que tratemos. En las estructuras más comunes se representa con la letra a y con la c en caso de haber dos. Nodos o átomos por celda: Tal y como dice el nombre es el número de nodos o átomos que posee cada celda. Una celda cuadrada, por ejemplo, poseerá un nodo por celda ya que cada esquina la comparte con cuatro celdas más. De hecho si una celda posee más de un nodo de red es que no es unitaria, en cambio si posee más de un átomo por celda pudiera ser que estuviésemos en una celda unitaria pero con una base atómica de más de un átomo. Número de coordinación: Es el número de puntos de la red más cercanos, los primeros vecinos, de un nodo de la red. Si se trata de una estructura con empaquetamiento compacto el número de coordinación será el número de átomos en contacto con otro. El máximo es 12. Factor de empaquetamiento: Fracción del espacio de la celda unitaria ocupada por los átomos, suponiendo que éstos son esferas sólidas.
Donde f es el factor de empaquetamiento o fracción de volumen ocupado, n el número de átomos por celda, v el volumen del átomo y Vc el volumen de la celda. Normalmente se suele dar el factor de empaquetamiento compacto para las diferentes celdas como indicador de la densidad de átomos que posee cada estructura cristalina. En este caso los átomos se tratan como esferas rígidas en contacto con sus vecinos más cercanos. Densidad: A partir de las características de la red, puede obtenerse la densidad teórica del material que conforma la red mediante la siguiente expresión.
Donde ρ es la densidad, NA el número de Avogadro y m la masa atómica. Volumen de la celda unitaria primitiva: Toda celda unitaria tiene el mismo volumen representado por la siguiente fórmula.
Redes bidimensionalesSegún los ángulos y la distancia entre los nodos se distinguen 5 redes distintas.
Redes tridimensionalesEn función de los parámetros de la celda unitaria, longitudes de sus lados y ángulos que forman, se distinguen 7 sistemas cristalinos. Ahora bien, para determinar completamente la estructura cristalina elemental de un sólido, además de definir la forma geométrica de la red, es necesario establecer las posiciones en la celda de los átomos o moléculas que forman el sólido cristalino; lo que se denominan puntos reticulares. Las alternativas son las siguientes:
Combinando los 7 sistemas cristalinos con las disposiciones de los puntos de red mencionados, se obtendrían 28 redes cristalinas posibles. En realidad, como puede demostrarse, sólo existen 14 configuraciones básicas, pudiéndose el resto obtener a partir de ellas. Estas estructuras se denominan redes de Bravais.
Base atómicaEn el caso más sencillo, a cada punto de red le corresponderá un átomo, pero en estructuras más complicadas, como materiales cerámicos y compuestos, cientos de átomos pueden estar asociados a cada punto de red formando celdas unitarias extremadamente complejas. La distribución de estos átomos o moléculas adicionales se denomina base atómica y esta nos da su distribución dentro de la celda unitaria. Existen dos casos típicos de bases atómicas. La estructura del diamante y la hexagonal compacta. Para redes bidimensionales un caso ejemplar sería el grafito cuya estructura sigue un patrón de red en panal.
Véase también
Enlaces externos |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Redes_de_Bravais publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Enciclopedia

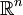 tiene la forma:
tiene la forma:
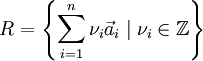



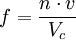
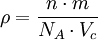
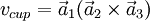 Donde a son los vectores de la base de la red.
Donde a son los vectores de la base de la red.
