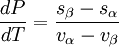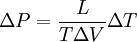|
En termoquímica, la relación de Clausius-Clapeyron es una manera de caracterizar la transición de fase entre dos estados de la materia, como el líquido y el sólido. En un diagrama P-T (presión-temperatura), la línea que separa ambos estados se conoce como curva de coexistencia. La relación de Clausius-Clapeyron da la pendiente de dicha curva. Matemáticamente se puede expresar como: Conocimientos adicionales recomendadosdonde DerivaciónSupongamos dos fases, α y β, en contacto y en equilibrio ambas. Los potenciales químicos se relacionan según μα = μβ. A lo largo de la curva de coexistencia, tenemos que dμα = dμβ. Usando la relación de Gibbs-Duhem dμ = − sdT + vdP donde s y v son, respectivamente, la entropía y el volumen por partícula, obtenemos:
Reordenamos la expresión y obtenemos De la relación entre el cambio de calor y entropía en un proceso reversible δQ = TdS, tenemos que la cantidad de calor añadido en la reacción es
...y combinando las dos últimas ecuaciones obtenemos la relación estándar. AplicaciónEsta ecuación puede ser usada para predecir dónde se va a dar una transición de fase. Por ejemplo, la relación de Clausius-Clapeyron se usa frecuentemente para explicar el patinaje sobre hielo: el patinador, con la presión de sus cuchillas, aumenta localmente la presión sobre el hielo, lo cual lleva a éste a fundirse. ¿Funciona dicha explicación? Si T=−2 ºC, podemos emplear la ecuación de Clausius-Clapeyron para ver qué presión es necesaria para fundir el hielo a dicha temperatura. Asumimos que y sustituyendo en L = 3.34·105 J/kg, T=293K, ΔV = -9.05·10-5 m3/kg, y
obtenemos
Esta presión es la equivalente a la de un peso de 150 kg (luchador de sumo) situado sobre unos patines de área total de contacto con el hielo de 0,5 cm². Evidentemente, éste no es el mecanismo por el cual se funde el hielo bajo las cuchillas de los patines (es un efecto de calentamiento por fricción). |
| Este articulo se basa en el articulo Relación_de_Clausius-Clapeyron publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia

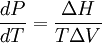



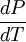 es la pendiente de dicha curva,
es la pendiente de dicha curva,