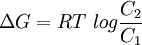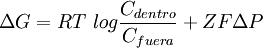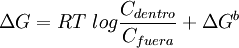|
En biología celular se denomina transporte de membrana al conjunto de mecanismos que regulan el paso de solutos, como iones y pequeñas moléculas, a través de membranas biológicas, esto es, bicapas lipídicas que poseen proteínas embebidas en ellas. Dicha propiedad se debe a la selectividad de membrana, una característica de las membranas biológicas que las faculta como agentes de separación específica de sustancias de distinta índole química; es decir, la posibilidad de permitir la permeabilidad de ciertas sustancias pero no de otras.[1] Los movimientos de casi todos los solutos a través de la membrana están mediados por proteínas transportadoras de membrana, más o menos especializadas en el transporte de moléculas concretas. Puesto que la diversidad y fisiología de las distintas células de un organismo está relacionada en buena medida con su capacidad de captar unos u otros elementos externos, se postula que debe existir un acervo de proteínas transportadoras específico para cada tipo celular y para cada momento fisiológico determinado;[1] dicha expresión diferencial se encuentra regulada mediante: la transcripción diferencial de los genes codificantes para esas proteínas y su traducción, es decir, mediante los mecanismos genético-moleculares, pero también a nivel de la biología celular: dichas proteínas pueden requerir de activación mediada por rutas de señalización celular, activación a nivel bioquímico o, incluso, de localización en vesículas del citoplasma.[2] Conocimientos adicionales recomendados
GeneralidadesTermodinámicamente, el flujo de sustancias de un compartimento a otro puede realizarse a favor o en contra de un gradiente, ya sea de concentración, o electroquímico. Si el intercambio de sustancias se realiza a favor del gradiente, esto es, en el sentido de los potenciales decrecientes, el requirimiento de energía externo al sistema es nulo; si, en cambio, el transporte se hace en contra del gradiente, se requiere el aporte de energía, energía metabólica en nuestro caso.[3] Por ejemplo, un mecanismo químico de separación clásico que no requiere un aporte de energía externo es la diálisis: en ella, una membrana semipermeable separa dos soluciones que difieren en la concentración de un mismo soluto. Si la membrana permite el paso de agua pero no el del soluto, sucede que el agua fluye hacia el compartimento más concentrado en soluto, a fin de establecer un equilibrio en el cual la energía del sistema sea mínima. Para que suceda este flujo, puesto que el agua se desplaza de un lugar muy concentrado a uno muy diluido en disolvente (en cuanto a soluto, se da la situación opuesta), y, por ello, lo hace a favor de gradiente, no se requiere un aporte de energía externo.
La naturaleza de las membranas biológicas, especialmente la de sus lípidos, es anfipática, lo que se traduce en que forman una bicapa que alberga una parte interna hidrofóbica y una externa hidrofílica, permite que surja una posibilidad de transporte, la difusión simple o difusión pasiva, que consiste en la difusión de sustancias a su través sin gasto de energía metabólica y sin ayuda de proteínas transportadoras. En el caso de que la sustancia a transportar posea una carga neta, difundirá no sólo en respuesta a un gradiente de concentración, sino también al potencial de membrana, esto es, al gradiente electroquímico.
Puesto que son pocas las moléculas que son capaces de difundir a través de una membrana lipídica, la mayoría de los procesos de transporte involucran a proteínas de transporte. Se trata de proteínas transmembrana que poseen multitud de hélices alfa inmersas en la matriz lipídica o bien, al menos en bacterias, beta láminas.[4] Dicha estructura probablemente implique una vía de entrada a través de entornos hidrofílicos proteicos que causarían una disrupción en el medio altamente hidrofóbico constituido por los lípidos.[1] Las proteínas intervienen de diversas formas en el transporte: actúan tanto como bombas impulsadas por ATP, esto es, por energía metabólica, o como canales de difusión facilitada. TermodinámicaUn proceso fisiológico sólo puede llevarse a cabo si no contraviene los principios termodinámicos elementales. El transporte de membrana obedece algunas leyes físicas que definen sus capacidades y por ello su utilidad biológica. Un principio general de la termodinámica que gobierna la transferencia de sustancias a través de membranas u otras supeficies es que el cambio de la energía libre, ΔG, para el transporte de un mol de una sustancia concentrada a C1 en un compartimento, hacia un lugar en el que esté a C2, es de:[5] Por lo que si C2 es menor que C1, ΔG es también negativo, y el proceso es termodinámicamente favorable. Conforme se va transfieriendo la energía de un compartimento a otro, y salvo que intervengan otros factores, se llega a un equilibrio donde C2=C1, y por ello ΔG=0. No obstante, existen tres circunstancias enl as que puede evitarse esta igualdad, circunstancias vitales para el desempeño de la función in vivo de las membranas biológicas:[5]
TiposDifusión simple
Como se mencionó anteriormente, la difusión pasiva es un fenómeno espontáneo puesto que suceden incrementando la entropía del sistema, y disminuyendo la energía libre.[5] No requiere de la intervención de proteínas de membrana, pero sí de las características de la sustancia a transportar y de la naturaleza de la bicapa. Para el caso de una membrana fosfolipídica pura, la velocidad de difusión de una sustancia depende de su:
Estos factores afectan de diversa manera a la velocidad de difusión pasiva:
La difusión simple a través de la membrana lipídica muestra una cinética de no saturación, esto es, que, puesto que la tasa neta de entrada está determinada sólo por la diferencia en el número de moléculas a cada lado de la membrana, la entrada aumenta en proporción a la concentración de soluto en el fluido extracelular. Esta característica distingue la difusión simple de los mecanismos de penetración por canales de transporte mediado.[6] Difusión facilitada
Bajo el mismo principio termodinámico que en el caso de la difusión simple, es decir, que el soluto a transportar lo hace a favor de gradiente, la difusión facilitada opera de modo similar, pero está facilitada por la existencia de proteínas canal, que son las que facilitan el transporte de, en este caso, agua o algunos iones y moléculas hidrófilas. Estas proteínas integrales de membrana conforman estructuras en forma de poro inmersas en la bicapa, que dejan un canal interno hidrofílico que permite el paso de moléculas altamente lipófobas como las mencionadas anteriormente. La apertura de este canal interno puede ser constitutiva, es decir, continua y desregulada, en los canales no regulados, o bien puede requirir una señal que medie su apertura o cierre: es el caso de los canales regulados.[1] Transporte activo y cotransporteEn él se efectúa un transporte en contra del gradiente de concentración o electroquímico y, para ello, las proteínas transportadoras implicadas consumen energía metabólica (comúnmente adenosín trifosfato). La hidrólisis del compuesto que actúa como moneda energética puede ser muy evidente, como en el caso de los transportadores que son ATPasas, o puede tener un origen indirecto: por ejemplo, los cotransportadores emplean gradientes de determinados solutos para impulsar el transporte de un determinado compuesto en contra de su gradiente, a costa de la disipación del primer gradiente mencionado. Pudiera parecer que en este caso no interviene un gasto energético, pero no es así puesto que el establecimiento del gradiente de la sustancia transportada colateralmente al compuesto objetivo ha requerido de la hidrólisis de ATP en su generación mediante unos determinados tipos de proteínas denominados bombas.[2] Por ello, se define transporte activo primario como aquél que hidroliza ATP de forma directa para transportar el compuesto en cuestión, y transporte activo secundario como aquél que utiliza la energía almacenada en un gradiente electroquímico. El descubrimento de la existencia de este tipo de transportadores se produjo al estudiar cinéticamente la transferencia de moléculas a través de las membranas: para algunos solutos, se observó que la velocidad de entrada alcanza una meseta a partir de cierta concentración externa a partir de la cual no se produce un incremento significativo de velocidad de captación, esto es, surge una respuesta tipo curva logística. Se interpretó que el transporte aquí se produce por la formación de un complejo sustrato-transportador, conceptualmente idéntico al complejo enzima-sustrato de la cinética enzimática. Por ello, cada proteína transportadora posee una constante de afinidad por el soluto que es igual a la concentración del soluto cuando la velocidad de transporte es la mitad de su valor máximo (equivaldría, para el caso de un enzima, a la constante de Michaelis-Menten).[6] Algunos rasgos importantes del transporte activo, además de su capacidad de intervenir aun en contra de gradiente, su cinética y el empleo de ATP, son: su elevado grado de selectividad y su facilidad de inhibición farmacológica selectiva.[6] Transportadores
Un transportador puede movilizar diversos iones y moléculas; según la direccionalidad, se distinguen:
Ambos reciben el nombre de contransportadores. Bombas
Una bomba es una proteína que hidroliza ATP para transportar a través de una membrana un determinado soluto a fin de generar un gradiente electroquímico que confiera unas características de potencial a ésta. Dicho gradiente posee un interés por sí mismo para la definición del estado de la célula, como es el potencial de Nernst, pero interviene activamente en el transporte de sustancias a través de la membrana, que es el tema aquí tratado, puesto que aporta un aumento de entropía al sistema en caso de cotransporte de sustancias que se encuentran en trasiego en contra de su gradiente. Una de las bombas de mayor relevancia en células animales es la bomba sodio-potasio, que opera mediante el mecanismo siguiente:[7]
Selectividad de membranaPuesto que la característica primordial del transporte a través de una membrana biológica es la selectividad de ésta y su subsiguiente actuación como barrera específica para determinadas sustancias, la fisiología subyacente de este fenómeno ha sido estudiada profusamente. Clásicamente se ha dividido el estudio de esta propiedad en lo referente a electrolitos y a no electrolitos. Selectividad para electrolitos
Los canales iónicos definen un diámetro interno que permite el paso de pequeños iones de forma más o menos específica. Puesto que el tamaño del ion está relacionado con la especie química, se podría asumir a priori que un canal cuyo diámetro de poro fuera suficiente para el paso de un ion permitiría asimismo el trasiego de otros de menor tamaño, cosa que no sucede en la mayoría de los casos. Existen dos características ajenas al tamaño que son importantes en la determinación de la selectividad de los poros de la membrana: la facilidad de deshidratación e interacción con las cargas del interior del poro.[6] Para que un ion penetre en el poro, debe disociarse de las moléculas de agua que lo recubren en sucesivas capas de solvatación. La tendencia a deshidratarse, o la facilidad para hacerlo, está relacionada con el tamaño del ion: los iones grandes lo hacen con más facilidad que los pequeños, por lo que un poro con centros polares débiles admitirá preferentemente iones grandes, antes que pequeños.[6] Cuando el interior del canal está tapizado de grupos polares, procedentes de las cadenas laterales de sus aminoácidos componentes,[7] la interacción del ion deshidratado con estos centros puede ser más importante que la facilidad de deshidratación para conferir la especificidad del canal. Por ejemplo, un canal revestido de histidinas y argininas, con grupos cargados positivamente, repelerá de forma selectiva a los iones cargados con el mismo signo, pero facilitará el paso de los cargados negativamente. Además, en este caso, los iones más pequeños pueden interactuar de forma más cercana por cuestiones estéricas, lo cual incrementa en mucho las interacciones carga-carga y, por tanto, exagera el efecto.[6] Selectividad para no electrolitosLos no electrolitos, sustancias que generalmente son hidrofóbicas y lipofílicas, suelen atravesar la membrana por disolución en la bicapa lipídica y, por tanto, mediante difusión simple. La facilidad para difundir en este caso es dependiente del coeficiente de partición K, por lo general, si bien existen algunos no electrolitos que atraviesan la membrana por transporte mediado por un transportador. En el caso de que el no electrolito esté parcialmente cargado, es decir, sea más o menos polar, como es el caso del etanol, metanol o urea, se permite el paso a través de la memebrana mediante canales acuosos inmersos en la membrana. Es interesante recalcar que no existe un mecanismo de regulación efectivo que establezca barreras a este transporte, lo que implica una vulnerabilidad intrínseca de las céulas a la penetración de estas moléculas.[6] Referencias
|
|||||||||||||||||||
| Este articulo se basa en el articulo Transporte_de_membrana publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia