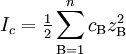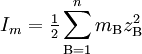|
La fuerza iónica, I, de una disolución es una función de la concentración de todos los iones presentes en el medio, definida como: Conocimientos adicionales recomendados
donde cB es la concentración de iones B, zB es la carga de cada ion, y el sumatorio se refiere a cada una de las especies iónicas presentes en el medio. A la vista de la definición mostrada, se puede comprobar como la multivalencia de los electrolitos presentes en el medio contribuye en gran medida a aumentar la fuerza iónica con respecto a la concentración. Así, para una disolución formada por cloruro de sodio, NaCl, la fuerza iónica es igual a la concentración, dado que en el medio hay iones Na+ y Cl -, ambos de igual carga (1) pero signo contrario. Sin embargo en una disolución de sulfato de magnesio, MgSO4, la fuerza iónica es cuatro veces mayor que la concentración, dado que existen iones Mg+2 y SO4-2 con una carga el doble que la del cloruro sódico. Dado que en las disoluciones no ideales los volúmenes no son estríctamente aditivos, es aconsejable trabajar con molalidad como unidad de concentración. En este caso, la fuerza iónica quedaría definida como:
ImportanciaLa fuerza iónica juega un papel muy importante en la Teoría de Debye-Hückel, capaz de describir las desviaciones con respecto a la idealidad típicamente encontradas en las disoluciones iónicas. También se hace necesaria en el estudio y en la caracterización físico-química de los coloides, y, por tanto, en su descripción mediante la Teoría DLVO. Ello se debe a que se requiere el parámetro de la longitud de Debye, definida como la inversa del parámetro de Debye , κ, es inversamente proporcional a la raíz cuadrada de la fuerza iónica. Al incrementarse la fuerza iónica por un aumento de la concentración o la valencia de los contraiones, se produce una disminución en la doble capa eléctrica y un incremento en el gradiente de potencial. ReferenciasCompendium of Chemical Terminology, Electronic version |
| Este articulo se basa en el articulo Fuerza_iónica publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia