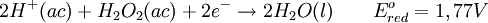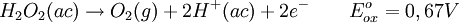El peróxido de hidrógeno (H2O2), es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno tal como el agua, que por lo general se presenta como un líquido ligeramente más viscoso que éste. Es conocido por ser un poderoso oxidante. También conocido como agua oxigenada, es un líquido incoloro a temperatura ambiente con sabor amargo. Pequeñas cantidades de peróxido de hidrógeno gaseoso ocurren naturalmente en el aire. El peróxido de hidrógeno es inestable y se descompone rápidamente a oxígeno y agua con liberación de calor. Aunque no es inflamable, es un agente oxidante potente que puede causar combustión espontánea cuando entra en contacto con materia orgánica o algunos metales, como el cobre, la plata o el bronce. El peróxido de hidrógeno se encuentra en bajas concentraciones (3-9%) en muchos productos domésticos para usos medicinales y como blanqueador de vestimentas y el cabello. En la industria, el peróxido de hidrógeno se usa en concentraciones más altas para blanquear telas y pasta de papel, y al 90% como componente de combustibles para cohetes y para fabricar espuma de caucho y sustancias químicas orgánicas. En otras áreas como en la investigación se utiliza para medir la actividad de algunas enzimas como la catalasa. Conocimientos adicionales recomendados
Propiedades fisicoquímicasEl peróxido de hidrógeno puro ( EstereoquímicaDe forma similar a la del agua, el Peróxido de hidrógeno presenta un eje de simetría ReactividadEl peróxido de hidrógeno concentrado, es una sustancia peligrosamente reactiva, debido a que su descomposición para formar agua y oxígeno es sumamente exotérmica. La siguiente reacción termoquímica demuestra ese hecho: La descomposición puede tener lugar con una violencia explosiva, si el peróxido de hidrógeno a altas concentraciones se pone en contacto con sustancias que pueden catalizar la reacción, por ello el peróxido de hidrógeno es etiquetado como reactivo químico en disoluciones acuosas de más del Rol como agente oxidante y reductorEl peróxido de hidrógeno es capaz de actuar ya sea como agente oxidante o como reductor. Las ecuaciones que se muestran a continuación presentan las semirreacciones en medio ácido: En solución básica, los potenciales correspondientes al electrodo estándar, son de 0,87 V para la reducción del peróxido de hidrógeno y de 0,08 V para su oxidación. ToxicidadEl peróxido de hidrógeno es tóxico, e incluso puede causar embolias al descomponerse dentro del aparato digestivo debido a liberación de burbujas de oxigeno. El peróxido de hidrógeno es muy irritante en concentraciones altas, ya que causa quemaduras temporales al desprenderse en la reacción el oxígeno. El peróxido de hidrógeno en concentraciones menores al 3% es usado en todo el mundo para curar varias enfermedades, como algunos tipos de cáncer y esclerosis múltiple entre otras y su uso es cada día más conocido, (ver oxigeno terapias o tratamientos con peróxido de hidrógeno). El peróxido de hidrógeno de uso doméstico al 3% no puede ser usado para ingerir o para ningún tratamiento de oxigenoterapia ya que contiene gran cantidad de estabilizantes y metales que son muy dañinos al cuerpo humano, el peróxido para terapias tiene que ser peróxido puro, sin ningún tipo de metal ni estabilizadores y su concentración es menor al 3%. Inhalar el producto para uso doméstico (3%) puede producir irritación de las vías respiratorias, mientras que el contacto con los ojos puede producir leve irritación de los ojos. Inhalar vapores de las soluciones concentradas (más del 10%) puede producir grave irritación pulmonar. La ingestión de soluciones diluidas de peróxido de hidrógeno puede inducir vómitos, leve irritación gastrointestinal, distensión gástrica, y en raras ocasiones, erosiones o embolismo (bloqueo de los vasos sanguíneos por burbujas de aire) gastrointestinal. Ingerir soluciones de 10-20% de concentración produce síntomas similares, sin embargo, los tejidos expuestos pueden también sufrir quemaduras. Ingerir soluciones aun más concentradas, además de lo mencionado anteriormente, puede también producir rápida pérdida del conocimiento seguido de parálisis respiratoria. El contacto de una solución del 3% de peróxido de hidrógeno con los ojos puede causar dolor e irritación, sin embargo las lesiones graves son raras. La exposición a soluciones más concentradas puede producir ulceración o perforación de la córnea. El contacto con la piel puede producir irritación y descoloramiento pasajero de la piel y el cabello. El contacto con soluciones concentradas puede causar graves quemaduras de la piel y ampollas. Se desconoce si la exposición al peróxido de hidrógeno puede afectar la reproducción en seres humanos. AplicacionesIndustrialesEl peróxido de hidrógeno tiene muchos usos industriales como el blanqueo de la pulpa de papel, blanqueo de algodón, blanqueo de telas y en general cada dia se usa mas como substituto del cloro. En la industria alimenticia de usa mucho para blanquear quesos, pollos, carnes, huesos y también se usa en el proceso para la elaboración de aceites vegetales. En la industria química se usa como reactivo y es muy importante en la elaboración de fármacos... AeroespacialEl peróxido de hidrógeno se usa en la industria aeroespacial como combustible de cohetes en motores de cohete monopropelantes o como aportación de oxigeno en motores bi-propelantes, este peróxido se usa por lo general a una concentración del 90% y es extremadamente puro. También se usa en concentraciones al 80% como impulsor de las turbobombas que alimentan tanto el combustible como el oxidante en grandes motores de cohete. Restauración de objetos de arteEl peróxido de hidrógeno se emplea en trabajos de restauración. En muchas pinturas antiguas, los pigmentos blancos a base de carbonato de plomo (II) se han decolorado debido a la formación del sulfuro de plomo (II), que posee un particular color negro. El peróxido de hidrógeno, reacciona de manera que logra convertir el sulfuro de plomo (II) a sulfato de plomo (II) (color blanco). Ambas sales son insolubles en agua. La reacción es como se muestra en la ecuación. DesinfecciónEs un antiséptico general. Su mecanismo de acción se debe a la efervescencia que produce, ya que la liberación de oxígeno destruye los microorganismos anaerobios estrictos, y el burbujeo de la solución cuando entra en contacto con los tejidos y ciertas sustancias químicas, expulsa restos tisulares fuera del conducto. Utilizado en dermoaplicaciones, limpieza de dentaduras y desinfección bucal. Además aprovechando la actividad de la peroxidasa presente en la sangre también se usa junto a la fenolftaleína para detectar la presencia de ésta (test de Kastle-Meyer). Otros usos domésticos
Enlaces externos
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Peróxido_de_hidrógeno publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Enciclopedia





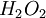 ), es un líquido denso y claro, con una densidad de
), es un líquido denso y claro, con una densidad de 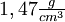 a 0
a 0 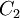 , (eje rotado a 180°) y además presenta tres conformaciones cis-planar (grupo de simetría C2v), cis-no planar (grupo de simetría C2) y trans-planar (grupo de simetría C2h). De ellos se ha demostrado experimentalmente que la forma espacial trans-planar es más estable que las configuraciones cis.
, (eje rotado a 180°) y además presenta tres conformaciones cis-planar (grupo de simetría C2v), cis-no planar (grupo de simetría C2) y trans-planar (grupo de simetría C2h). De ellos se ha demostrado experimentalmente que la forma espacial trans-planar es más estable que las configuraciones cis.
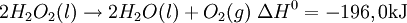
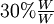 . Una solución que contiene cerca del
. Una solución que contiene cerca del 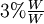 de
de