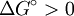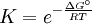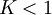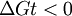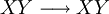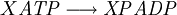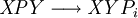|
En la termoquímica, una reacción endergónica (también llamada reacción desfavorable o no espontánea) es una reacción química en donde el incremento de energía libre es positivo. Bajo condiciones de temperatura y presión constantes, esto quiere decir que el incremento en la energía libre de Gibbs estandar debe ser positivo para una reacción en estado estándar (a una presión estándar (1 Bar), y unas concentraciones estándar (1 molar) de todos los reactivos y productos). Conocimientos adicionales recomendados
Constante de equilibrioLa constante de equilibrio de la reacción esta relacionado a ΔG° por la relación: donde T es la temperatura absoluta y R es el la constante de los gases ideales. Un valor positivo de ΔG° entonces implica de modo que a partir de las cantidades de estequiometricas una reacción se moverían hacia la izquierda del equilibrio y no a la derecha. Sin embargo, las reacciones endergónica son bastante frecuentes en la naturaleza, especialmente en la bioquímica y fisiología. Algunos ejemplos de reacciones endergónicas en células incluye la síntesis de proteínas, y el bombeo de Na /K que produce la conducción nerviosa y la contracción muscular. Esto es debido a que la reacciones endorgómicas (no espontáneas) están asociadas a reacciones espontáneas de forma que el incremento de energía libre total si que es negativo considerando ambas reacciones globalmente. Haciendo que las reacciones endergónicas transcurranLas reacciones endergónicas pueden tanscurrir si se 'empuja' o 'tira' de ellas con un proceso exergónico (aumentando de estabilidad, lo que produce un incremento negativo de la energía libre). Tirando de la reacciónSe puede 'tirar' de los rectivos através de una reacción endergónica, si los productos de la reacción desaparecen rápidamente debido una reacción exergónica subsiguiente. La concentración de los productos de la reacción endergónica debe mantenerse siempre baja para que la reacción tenga lugar. Un ejemplo clásico de esto puede ser el primer estado de una reacción que transcurre mediante un estado de transición. El proceso de alcanzar el máximo del la barrera de energía de activación del estado de transición es endergónico. Sin embargo, la reacción tiene lugar porque habiendo alcanzado el estado de transición, se ve rápidamente involucrada en un proceso exergónico hasta un estado final mas estable. Empujando la reacciónUna reacción endergónica se puede 'empujar' acoplándola a otra reacción que sea fuertemente exorgónica, a través de un intermediario compartido. Esto es frecuente en las reacciones biológicas. Por ejemplo la reacción puede ser demasido endergónica para que tenga lugar. Sin embargo, es posible que acoplándola a una reacción fuertemente exergónica – como, muy a menudo, es la descomposición de ATP en ADP y fosfato inorgánico, ATP → ADP Pi, así que En este tipo de reacciones, con la descomposición de ATP se aporta la energía libre necesaria para que la reacción endergónica transcurra, es por esto frecuente que en bioquímica celular se llame al ATP "moneda universal de energía" de todos los oraganismos vivos. Categoría: Termodinámica |
|
| Este articulo se basa en el articulo Reacción_endergónica publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia