|
En química, la simetría molecular describe la simetría de las moléculas y utiliza este criterio para su clasificación. La simetría molecular es un concepto fundamental en química, pues muchas de las propiedades químicas de una molécula, como su momento dipolar y las transiciones espectroscópicas permitidas (basadas en reglas de selección como la regla de Laporte) pueden predecirse o ser explicadas a partir de la simetría de la molécula. Aunque existen varios marcos teóricos en los que la simetría molecular puede estudiarse, la teoría de grupos es el principal. Existen muchas técnicas para establecer empíricamente la simetría molecular, incluyendo la cristalografía de rayos X y varias formas de espectroscopía. Conocimientos adicionales recomendados
Elementos de simetríaLa simetría de una molécula puede describirse según 5 tipos de elementos de simetría:
OperacionesLos 5 elementos de simetría tienen asociados 5 operaciones de simetría. Así, Ĉn es la rotación de una molécula alrededor de un eje y Ê es la operación de identidad. Un elemento de simetría puede tener más de una operación de simetría asociada. Puesto que C1 es equivalente a E, S1 a σ y S2 a i, todas las operaciones de simetría pueden clasificarse como rotaciones propias o impropias. Grupos puntuales
Un grupo puntual es un conjunto de operaciones de simetría que forman un grupo matemático para el que al menos un punto permanece fijo bajo todas las operaciones del grupo. En tres dimensiones hay 32 grupos, 30 de los cuales son relevantes en química. Teoría de gruposUn grupo se forma a partir de un conjunto de operaciones de simetría cuando:
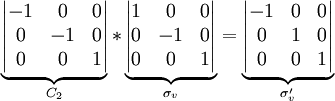
El orden de un grupo es el número de operaciones de simetría para tal grupo. Por ejemplo, el grupo puntual para la molécula de agua es C2v, con las operaciones de simetría E, C2, σv y σv'. Su orden es, por tanto, 4. Cada operación es su proia inversa. Como ejemplo de cierre, una rotación C2 seguida de una reflexión σv es una operación de simetría σv':
Grupos de puntos comunesLa siguiente tabla contiene una lista de grupos de puntos con moléculas representativas:
RepresentacionesLas operaciones de simetría pueden representarse de muchos modos. Una representación conveniente es por matrices, donde la composición de operaciones corresponde a la multipicación de matrices. En el ejemplo C2v: Aunque existe un número infinito de estas representaciones, normalmente se utilizan las representaciones irreducibles, pues las otras representaciones del grupo pueden describirse como combinaciones lineales de las representaciones irreducibles. Tablas de caracteresPara cada grupo puntual, una tabla de caracteres resume la información sobre sus operaciones de simetría y sobre sus representaciones. Dado que siempre existe un número idéntico de representaciones de simetría y de clases de operaciones de simetría, las tablas son cuadradas. La tabla consiste en una serie de caracteres que representan cómo una representación irreducible se transforma cuando se aplica una cierta operación de simetría. Cualquier operación de simetría aplicada a una molécula en su grupo puntual la dejará sin ningún cambio. Cuando actúa sobre una entidad genreal, como un vector espacial o un orbital, este no ha de ser el caso necesariamente. El vector puede cambiar de signo o dirección, y el orbital puede cambiar de tipo. Para grupos puntuales simples, los valores son 1 o −1: 1 significa que el signo o fase del vector u orbital no cambia bajo la operación de simetría (es simétrico), y −1 denota un cambio de signo (asimétrico). Las representaciones se nombran de acuerdo a un conjunto de convenciones:
Las tablas recogen también información sobre cómo los vectores cartesianos de base, las rotaciones alrededor de ellos y las funciones cuadráticas de los mismos transforman mediante la simetría operaciones del grupo, fijándose en que la irreductible representación se transforma del mismo modo. Estas indicaciones están normalmente en la parte derecha de las tablas. Esta información es importante, pues orbitales químicamente importantes (en particular, los orbitales p yd) tienen las mismas simetrías que estas entidades. La tabla de carácter para el grupo de simetría puntual C2v es:
En el ejemplo C2v, consideremos los orbitales atómicos del agua: el 2px está orientado perpendicularmente al plano de la molécula y cambia de signo con una operación C2 y σv'(yz), pero no cambia con las otras dos operaciones. Este conjunto de caracteres del orbital es, por tanto, {1, −1, 1, −1}, correspondiente a la representación irreducible B1. Del mismo modo, se entiende que el orbital 2pz tiene la simetría de la representación irreducible A1, 2py B2, y el oribital 3dxy A2. HistoriaHans Bethe utilizó los caracteres de las operaciones de grupos puntuales en su estudio de la teoría del campo del ligando en 1929. Eugene Wigner utilizó la teoría de grupos para explicar la vibración molecular. La primera tabla de caracteres fue compilada por László Tisza en 1933 en el contexto de los espectros de vibraciones. E. Bright Wilson los utilizó en 1934 para predecir la simetría de modos normales.[1] El conjunto completo de los 32 grupos puntuales fue publicado en 1936 por Rosenthal y Murphy.[2] Enlaces externos
ReferenciasCategoría: Química teórica |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Simetría_molecular publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




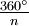 resulta en una molécula indistinguible de la original. El C2 en el agua y el C3 en el
resulta en una molécula indistinguible de la original. El C2 en el agua y el C3 en el