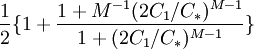|
Las membranas celulares se autoagregan a partir de fuerzas químicas, a continuación se profundizará sobre cómo estas fuerzas impulsan la autoagregación. Conocimientos adicionales recomendadosSi se tiene una mezcla de agua y aceite, se nota una separación entre estas dos sustancias a pesar de que hay un incremento superficial. La explicación a este fenómeno, es que las moléculas de agua son atraídas por el aceite, la interfaz aceite-agua rompe los puentes de hidrógeno de tal forma que las gotas de agua se agrupan reduciendo su área superficial. Existen sustancias como la mayonesa, que se componen de la mezcla de agua y aceite y sin embargo, no hay separación entre agua – aceite, este hecho radica, en la existencia de sustancias que estabilizan las suspensiones de aceite en agua y reciben el nombre de emulsificantes ó tensioactivos. La estructura molecular de un tensioactivo está compuesto de un lado hidrofóbico y uno hidrofilico, el primero esta constituido de una cadena de hidrocarburos, mientras el segundo, es polar y corresponde a un ión. A las moléculas estructuradas por la unión de estas dos partes se les denomina, anfifilios y, normalmente las partes se repartirían hacia la fase oleica y acuosa en la mezcla de aceite-agua. Sin embargo no hay separación entre la cabeza y la cola puesto que están unidas por Enlace químico, en la figura 1 se muestra la estructura de una clase de molécula de Fosfolípido. Al introducir el tensioactivo en la mezcla agua-aceite, las moléculas que lo componen satisfacen espontáneamente a sus dos mitades, ubicándose en la interfaz aceite-agua. Como se observa en la figura 2, la cabeza polar toca el agua y las no polares el aceite y, justo en la interfaz al anfifilo minimiza su energía libre rebajando la energía superficial retrasando la fundición de gotitas.
Las micelas se autoagregan súbitamente al llegar a una concentración críticaTeniendo en cuenta que un tensioactivo en una mezcla agua-aceite se ubica o migra a la interfaz, ¿qué sucedería si tengo un tensioactivo sólo en agua? y ¿qué ocurriría con sus colas hidrofóbicas? La respuesta a estas preguntas, es que estos tensioactivos se agruparían en una Micela, una esfera formada por pocas moléculas de tamaño óptimo y bien definidas a escala molecular. En esta posición las cabezas se expondrían al agua, mientras sus colas apolares no se exhiben al entorno, ver figura 3.
Al configurarse en una Micela, hay pérdida de entropía y cada molécula no se podría orientar en cualquier posición. Así la fuerza química que lleva a la autoagregación es el efecto hidrofóbico, una fuerza entrópica. McBain en 1913, ya había dado cuenta de la existencia de micelas bien definidas, realizando estudios cuantitativos de las disoluciones jabonosas. Se encontró, que parar disoluciones muy diluidas, la presión osmótica reproducía el número total de iones anfifílicos (como se muestra en la figura 4 con los símbolos negros) tal como ocurre con la sal. Análisis posteriores a partir de la figura 4, llevaron a la definición de concentración micelar crítica CMC, que explica como la razón entre los objetos móviles y el conjunto de iones disminuye bruscamente. Trabajos realizados por McBain y colaboradores, concluyeron que cada tipo de disolvente tiene su propio valor de CMC y éste disminuye a temperaturas altas, mostrando así que la interacción hidrofóbica es la causante de la autoagregación.
Para interpretar los resultados, se aplica la ley de acción de masas a la reacción (N monómeros) →(un agregado). Se tiene así, que la concentración de monómeros C1 libres en la disolución se relaciona con la concentración de las micelas CM , mediante la relación:
La concentración total vendrá dada por:
Cuando tenemos bajas concentraciones CT < < C * , predomina el primer término y se tiene CT − C1 aquí todas las moléculas del tensioactivo se encuentran separadas. Cuando se tiene una concentración por encima de CMC prevalece el segundo término, por lo cual Se puede encontrar la presión osmótica respecto al valor CTKBT, la contribución de los anfifilos se parece a la ecuación (4) sólo que cada micela cuenta sólo como un objeto, no con M objetos. La presión osmótica para este modelo vendrá dada por:
Véase también
Bibliografía
|
| Este articulo se basa en el articulo Autoagregación_de_Anfifilos publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




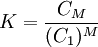 (1)
(1)
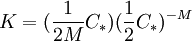 (4)
(4)
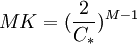 y reemplazando en (3) se obtiene finalmente:
y reemplazando en (3) se obtiene finalmente:
![C_{T}=C_{1}[1+2[\frac{C_{1}}{C_{*}}^{M-1}]]](images/math/5/1/c/51c89a791e7cbe794567586dd9b4ab27.png) (5)
(5)
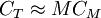 , en este caso las moléculas están agrupadas en micelas.
, en este caso las moléculas están agrupadas en micelas.