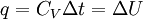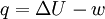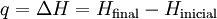|
La calorimetría se encarga de medir el calor en una reacción química o un cambio físico usando un calorímetro. La calorimetría indirecta calcula el calor que los organismos vivos producen a partir de la producción de dióxido de carbono y de nitrógeno (urea en organismos terrestres), y del consumo de oxígeno. Conocimientos adicionales recomendadosTemperatura y energía internaA cualquier temperatura sobre el cero absoluto, los átomos poseen distintas cantidades de energía cinética por la vibración. Ya que los átomos vecinos colisionan entre sí, esta energía se transfiere. Aunque la energía de los átomos individuales puede variar como resultado de estas colisiones, una serie de átomos aislados del mundo exterior tiene una cantidad de energía que no cambia porque va pasando de átomo a átomo. Conceptualmente, la energía promedio por átomo puede calcularse dividiendo la energía total por el número de átomos. La calorimetría se encarga de medir el calor en una reacción química o un cambio físico usando un calorímetro. La calorimetría indirecta calcula el calor que los organismos vivos producen a partir de la producción de dióxido de carbono y de nitrógeno (urea en organismos terrestres), y del consumo de oxígeno.
Si un objeto se aisla del resto del universo, su temperatura se mantendrá constante. Si la energía entra o sale, la temperatura deberá cambiar. La energía moviéndose de un lugar a otro se llama calor y la calorimetría usa las mediciones de los cambios de temperatura para registrar el movimiento de calor. Calorimetría a volumen constanteNo existe trabajo en la calorimetría de volumen constante, por lo que el calor medido es igual al cambio de energía interna del sistema: donde
Como la presión no se mantiene constante, el calor medido no representa el cambio de entalpía. En conclusión la calorimetría es una técnica de análisis térmico que permite medir los cambios energéticos de una sustancia en presencia de un material de referencia. Resulta de aplicación en estudio de polímeros, productos farmacéuticos, alimentos, etc. Calorimetría a presión constanteEl calor medido es igual al cambio en la energía interna del sistema menos el trabajo realizado: Como la presión se mantiene constante, el calor medido representa el cambio de entalpía. Categoría: Calorimetría |
| Este articulo se basa en el articulo Calorimetría publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia