|
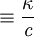 Conocimientos adicionales recomendadosSiendo κ la conductividad de la disolución y c la concentración estequiométrica molar del electrolito. Es una magnitud que depende del electrolito y del disolvente. UnidadesLas unidades de la conductividad molar en el SI son S EjemploLa conductividad, κ, de una disolución acuosa de KCl de concentración molar igual a 1,00 mol Conductividad molar a dilución infinitaSe trata del valor de la conductividad molar a concentración cero. Para electrolitos fuertes (totalmente disociados) se obtiene por extrapolación a cero de la conductividad molar cuando se representa frente a la raíz cuadrada de la concentración (Ley de Kohlrausch). Si el electrolito está débilmente disociado la ley de Kohlrausch no es aplicable para la determinación de este valor. |
| Este articulo se basa en el articulo Conductividad_molar publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia





