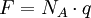|
La constante de Faraday (F) es utilizada en física y química, y se define como la cantidad de carga eléctrica en un mol de electrones. La constante de Faraday fue nombrada así en honor del científico británico Michael Faraday. Es utilizada en los sistemas electroquímicos para calcular la masa de los elementos que se formarán en un electrodo. Conocimientos adicionales recomendadosEstá representada por el símbolo F, y está dada por la ecuación: donde NA es el número de Avogadro (aproximadamente 6.02 x 1023 moles-1) y q es la magnitud de la carga de un electrón (aproximadamente 1.602 x 10-19 coulombs por electrón).
Aunque por el momento:
Categoría: Constantes físicas |
| Este articulo se basa en el articulo Constante_de_Faraday publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia