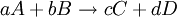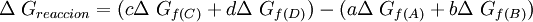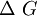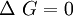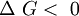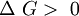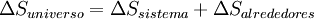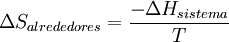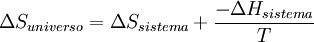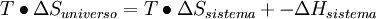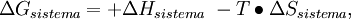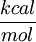|
En termodinámica, la energía libre de Gibbs (o entalpía libre) es un potencial termodinámico, es decir, una función de estado extensiva con unidades de energía, que da la condición de equilibrio y de espontaneidad para una reacción química (a presión y temperatura constantes). La segunda ley de la termodinámica postula que una reacción química espontánea hace que la entropía del universo aumente, Producto destacado
Cálculo de Energía libre de GibbsLos cambios en la energía libre
Cambios de energía libre estándarLa energía libre de reacción, se denota,
Donde A y B son los reactivos en estado estandar y; C y D son los productos en su estado estandar. Además a, b, c y d son sus respectivos coeficientes estequiométricos. en general:
donde m y n son los coeficientes estequiométricos. Así como en en el cálculo de la entalpía, en la energía libre estándar de formación para cualquier elemento en su forma estable (1 atm y 25ºC) es 0 Significado de
|
|
| Este articulo se basa en el articulo Energía_libre_de_Gibbs publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


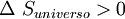 , así mismo
, así mismo 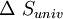 esta en función de
esta en función de 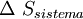 y
y 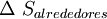 .Por lo general solo importa lo que ocurre en el sistema en estudio y; por otro lado el cálculo de
.Por lo general solo importa lo que ocurre en el sistema en estudio y; por otro lado el cálculo de 


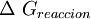 , es el cambio de energía en una reacción a condiciones estandares. En esta reacción los reactivos en su estado estandar se convierten en productos en su estado estandar
, es el cambio de energía en una reacción a condiciones estandares. En esta reacción los reactivos en su estado estandar se convierten en productos en su estado estandar