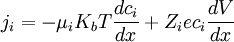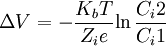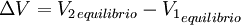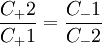|
El equilibrio de Gibbs - Donnan es el equilibrio que se produce entre los iones que pueden atravesar la membrana y los que no son capaces de hacerlo. Se juega con los iones y con las cargas.
Conocimientos adicionales recomendados
FundamentaciónCuando partículas de gran tamaño cargadas eléctricamente, como las proteínas, que no se difunden a través de una membrana semipermeable están presentes en un compartimento fluido como el vascular, atráen los iones cargados positivamente y repelen los iones cargados negativamente.(tal y como aparece en la figura). Como consecuencia de ello, se establece un gradiente eléctrico y sendos gradientes de concentración de los iones, estos dos últimos iguales y de signo opuesto. En el equilibrio, los productos de las concentraciones iónicas de cada lado de la membrana son iguales. En consecuencia, la concentración de partículas es desigual a ambos lados de la membrana y se establece un gradiente osmótico en dirección hacia el compartimiento que contiene las proteínas. Esta presión osmótica en el equilibrio de Gibbs-Donnan es de unos 6-7 mm de Hg. Equilibrio de Membrana de DonnanEl equilibrio de membrana de Donnan se basa en que a un lado de la membrana hay que "aplicar" una disolución "por ejemplo" cloruro sodico y al otro lado de la membrana un electrólito cargado negativamente, los iones que son de signo contrario pasan a través de la membrana, y los iones de cloruro y de sodio pasan sin ninguna dificultad por la membrana, los iones de las partículas aniónicas no pasan teniendo un equilibrio a lo largo de la membrana, como existe un equilibrio los volúmenes en la disolución a ambos lados de la membrana son idénticos, la actividad o concentración del cloruro sódico es la misma, por lo tanto, obedece al principio de tendencias de escape: [Na + ]e[Cl − ]e = [Na + ]i[Cl − ]i
La concentración de los iones cargados positivamente [Na + ]e en las disoluciones, a ambos lados de la membrana tiene que equilibrarse con la concentración de los iones de carga negativa [Cl − ]e, tal y como aparece a continuación Al exterior de la membrana [Na + ]e = [Cl − ]e Al interior de la membrana [Na + ]i = [R − ]i + [Cl − ]i "siendo R los iones de los electrolitos" Estas ecuaciones al introducirlas en la primera nos dan como resultado:
La razón de las concentraciones del anión difusible fuera y dentro de la membrana semipermeable depende de la concentración del polielectrolito que con carga negativa se encuentra en el interior del saco semipermeable, tratando de llevar iones de carga similar a la del agua hacia el exterior de la membrana. Cuando [R − ]i es grande comparada con [Cl − ]i la razón es, aproximadamente, igual a:
Distribución de la membranaAhora si la distribución de cargas en la membrana es distinta se produce un potencial en dicha membrana (potencial de donnan) el cual para que este en equilibrio se requiere: ji = 0 donde dicho índice nos indica que el potencial debe ser una propiedad intensiva del sistema dependiente de la concentración y del potencial eléctrico generado por las cargas.
Dado que el primer coeficiente es diferente de cero, lo que hace que la solución sea continua en todo el plano, entonces despejando la derivada direccional del potencial eléctrico e integrando la ecuación anterior nos resulta:
e integrando para la anterior ecuación se obtiene:
Implicación del equilibrio de Gibbs - DonnanLo que implica que la concentración de cargas dentro y fuera de la membrana debe poseer una estabilidad asociada en cuanto a la concentración de los iones en ambos lados es más si se considerase la membrana semipermeable como un agente catalizador produciría un gradiente de concentración en la membrana y sin embargo el equilibrio seria establecido así:
SimulaciónEn esta Simulación se muestran dos pasos: 1. En situación de equilibrio, existen una difusión espontánea de iones Cl, Na y K de modo que existe un potencial de membrana negativo.
ActualidadLos estudios actuales generados por este equilibrio de concentraciones membranales se encuentran principalmente en España, Argentina, Ecuador y Perú.
Análisis del potencial de equilibrio en las células excitables
En el Perú La Universidad Nacional Mayor de San Marcos a cargo de los profesores Dr. Cristian Andonaire - Dra. Imelda Domínguez tienen un grupo de investigación que centra sus estudios en: Dinámica de los fluídos en compartimentos
Transformación de energía en sistemas vivos
Enlaces externos actualidadhttp://www.uv.es http://www.unmsm.edu.pe http://www.unsam.edu.ar
Bibliografía
Categoría: Biofísica |
|
| Este articulo se basa en el articulo Equilibrio_de_Gibbs_Donnan publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




![\frac{[Cl^{-}]_{e}}{[Cl^{-}]_{i}}=\sqrt{1+\frac{[R^{-}]_{i}}{[Cl^{-}]_{i}}}](images/math/5/1/5/5159efc8c9ad0e545bd8e54a8fbdfb08.png)
![\sqrt{[R^{-}]_{i}}](images/math/5/8/2/582aaa4a7a7656a283e9f271aecc24af.png)