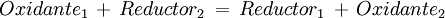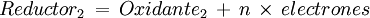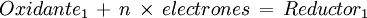|
Una reacción de oxidación reducción al equilibrio es una de la forma: Producto destacado
Que puede ser vista como la suma de dos semireacciones al equilibrio: Una oxidación de una sustancia que actúa como agente reductor, que cede electrones o incrementa su número de oxidación:
y una reducción de una sustancia que actúa como agente oxidante, que acepta electrones o decrementa su número de oxidación:
La tendencia de este equilibrio está determinada por los potenciales estandar ya sea de reducción o de oxidación de ambas semireacciones. Una sustancia se Oxida cuando aumenta su número de oxidación, es decir que aumenta el número de carbonos , puesto que los Hidrógenos y Oxidrilos también han aumentado, de ésta manera se necesita una cadena más larga de Carbonos (o un mayor número de Carbonos, como se quiera llamar), para que la sustancia esté en Equilibrio Químico. Una sustancia se Reduce cuando, por el contrario, disminuye su número de oxidación. Esto significa que disminuye el número de Carbonos e Hidrógenos y la cadena se acorta, para que pueda formarse el mismo Equilibrio Quimico. Categoría: Reacciones químicas |
| Este articulo se basa en el articulo Equilibrio_redox publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |

Último visto