|
La Ley de Raoult establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución. La ley debe su nombre al químico francés François Marie Raoult (1830-1901) Conocimientos adicionales recomendados
DefiniciónSi un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro. De esta forma la relación entre la presión de vapor de la disolución y la presión de vapor del disolvente depende de la concentración del soluto en la disolución. Esta relación entre ambos se formula mediante la Ley de Raoult mediante la cual: la presión parcial de un disolvente sobre una disolución P1 está dada por la presión de vapor del disolvente puro Po1, multiplicada por la fracción molar del disolvente en la disolución X1. Es decir que la presión de vapor del soluto crece linealmente con su fracción molar. En una solución que sólo contenga soluto, se tiene que X1=1-X2, donde X2 es la fracción molar del soluto, pudiendo escribir la formulación de la ley como: Se puede ver de esta forma que una disminución en la presión de vapor, ΔP es directamente proporcional a la concentración del soluto presente CaracterísticasUna vez que los componentes de la solución han alcanzado el equilibrio químico, la presión total del vapor es: y la presión individual de los componentes gaseosos es donde
Consecuentemente a medida que el número de componentes gaseosos va creciendo en la solución, la presión de los componentes individuales decrece, así como la fracción molar de cada uno de ellos que va decreciendo igualmente con la adicción de nuevos componentes. Si se tuviera un soluto puro, se alcanzaría el valor nulo de presión de vapor (es decir el cuerpo no se evaporaría). En este caso la presión de vapor de la disolución sería igual a la suma de las presiones parciales de cada componente (Ley de Dalton). Incumplimientos de la LeySe cumple sólo para disoluciones ideales no obstante es una buena aproximación cualitativa. Disoluciones idealesUna disolución ideal es aquella que cumple al 100% la ley de Raoult. En equilibrio Liquido - Vapor, la relación que se comporta
según la idealidad de la Ley de Raoult seria la siguiente
PT = La presión total del sistema en equilibrio Y1 = Composición en la fase vapor, compuesto 1 X1 = Composición en la fase Liquida, compuesto 1
EmpleoLa ley de Raoult suele emplearse en la teoría de la destilación. Véase tambiénLiteratura
|
|
| Este articulo se basa en el articulo Ley_de_Raoult publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |

Último visto

Enciclopedia




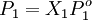
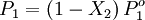
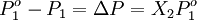
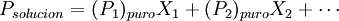
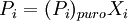
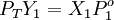 Donde
Donde
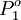 = Presión de vapor compuesto 1
= Presión de vapor compuesto 1
