|
Producto destacadoEl peso equivalente es el peso molecular de la sustancia dividido entre el número de protones (si es un ácido), el número de hidroxilos (si es una base), el número de ligandos (si es una especie formadora de complejos), o el número de electrones que intercambia (si es un par redox). En ocasiones, podemos conocer la cantidad de equivalentes (nequiv) en un determinado volumen (V), despejando la fórmula de normalidad (N).
Tipos de equivalentes
|
| Este articulo se basa en el articulo Equivalente publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




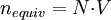
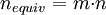 y
y 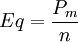 .
.
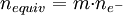 y
y 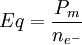 .
.

