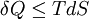|
En termodinámica, un proceso isoentrópico (combinación de la palabra griega "iso" - igual - y "entropía") es aquel en el que la entropía del fluido que forma el sistema permanece constante. Producto destacadoSegún la segunda ley de la termodinámica, se puede decir que: donde δQ es la cantidad de energía que el sistema gana por calentamiento, T es la temperatura del sistema, y dS es el cambio en la entropía. El símbolo de igualdad implicaría un proceso reversible. En un proceso isentrópico reversible no hay transferencia de energía calorífica, y por tanto el proceso es también adiabático. En un proceso adiabático irreversible, la entropía se incrementará, de modo que es necesario eliminar el calor del sistema (mediante refrigeración) para mantener una entropía constante. Por lo tanto, un proceso isentrópico irreversible no es adiabático. Para procesos reversibles, una transformación isentrópica se realiza mediante el aislamiento térmico del sistema respecto a su entorno. La temperatura es la variable termodinámica conjugada de la entropía, de modo que el proceso conjugado será isotérmico, y el sistema estará térmicamente conectado a un baño caliente de temperatura constante. Categoría: Procesos termodinámicos |
| Este articulo se basa en el articulo Proceso_isentrópico publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |