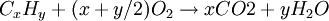|
La combustión es una reacción química en la que un elemento combustible se combina con otro comburente (generalmente oxígeno en forma de O2 gaseoso), desprendiendo calor y produciendo un óxido; la combustión es una reacción exotérmica que produce:
Conocimientos adicionales recomendadosEs la combinación rápida de un material con el oxigeno, acompañada de un gran desprendimiento de energía térmica y energía luminosa. Los tipos más frecuentes de combustible son los materiales orgánicos que contienen carbono e hidrógeno. El producto de esas reacciones puede incluir monóxido de carbono (CO), dióxido de carbono (CO2), agua (H2O) y cenizas. El proceso de destruir materiales por combustión se conoce como incineración. Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada ignición o de inflamación. Combustión completaCuando al reaccionar una sustancia orgánica con el oxígeno el producto resultante es sólo CO2 (g) y H2O (l); esto es, la combustión completa se produce cuando el total del combustible reacciona con el oxígeno, es decir, cuando toda la parte combustible se ha oxidado al máximo, es decir, no quedan residuos de combustible sin quemar. La fórmula de la combustión completa es: Véase también
|
| Este articulo se basa en el articulo Combustión publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia