|
|
| Nombre (IUPAC) sistemático
|
| Dicromato de amonio
|
| General
|
| Fórmula semidesarrollada
| (NH4)2Cr2O7
|
| Identificadores
|
| Número CAS
| n/d
|
| Propiedades físicas
|
| Estado de agregación | Sólido
|
| Apariencia | Anaranjado intenso
|
| Densidad
| 2.150 kg/m3; 2.15 g/cm3
|
| Masa
| 252.07 u
|
| Punto de fusión
| 453 K ( °C)
|
| Punto de ebullición
| se descompone a 453 K ( °C)
|
| Propiedades químicas
|
| Solubilidad en agua
| 364 g/l a 20 °C en agua
|
| KPS
| n/d
|
Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referencias
| El dicromato de amonio es es una sal del hipotético ácido dicrómico (este ácido en sustancia no es estable) . Se trata de una sustancia de color intenso anaranjado. Es un oxidante fuerte. En contacto con sustancias orgánicas puede provocar incendio u explosión.
Es fundamentalmente conocido por su uso en la demostración de la descomposición térmica de una sustancia, ya que al ser calentada o encendida por una llama, se produce la reacción:
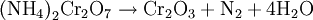
La reacción se produce debido al poder oxidante del ión dicromato y al reductor del ión amonio. Otro ejemplo es la reacción de descomposición explosiva del nitrato de amonio. Actualmente, esta experiencia se realiza cada vez menos debido a la toxicidad de uno de los productos: el óxido de cromo (III).
Aplicaciones
Era antiguamente usada en pirotecnia y en fotografía, y actualmente se la utiliza como mordiente en la industria textil, para purificar grasas o aceites, y como oxidante en síntesis orgánica.
Toxicología
El dicromato de amonio es tóxico. En contacto con la piel se produce sensibilización y se pueden provocar alergias.
Al igual que los cromatos los dicromatos son cancerígenos. En el cuerpo son confundidos por los canales iónicos con el sulfato y pueden llegar así hasta el núcleo de la célula. Allí son reducidos por la materia orgánica presente y el cromo(III) formado ataca a la molécula de la ADN.
|