|
Puesto que las moléculas están en una solución en general acuosa, hay que tener en cuanta que ambos poseen dipolos permanentes, por tanto se necesitan 2 constantes dieléctricas tanto para el soluto como para el solvente. Si se considera simplemente una constante dieléctrica para describir la respuesta soluto y solvente, y usando la ley de Coulomb, los resultados difieren de la evidencia experimental, puesto que es sabido que la constante dieléctrica del agua es 80 y de algunas proteínas del orden de 4. La respuesta dieléctrica de los dipolos permanentes puede ser modelada. Algunos de los modelos usados son: Conocimientos adicionales recomendados
Representaciones explícitas de los átomosSi se describe explícitamente la interacciones entre moléculas por medio de funciones potenciales tanto soluto como solvente (moléculas) se puede aplicar la ley de Coulomb para cargas y por medio de métodos que expliquen la dinámica del sistema se puede dar solución al fenómeno electrostático. Se pueden encontrar dificultades computacionales al modelar las interacciones ya que todas las propiedades del dieléctrico (agua) no pueden ser descritas. Representación mecánica estadísticaModelo de LangevinEn gases y líquidos dieléctricos polares puesto que la agitación térmica se puede visualizar desde el punto de vista como choques intermoleculares, estos tienden a destruir alguna orientación preferencial respecto al campo total, por tanto esta fuerza se comporta como restauradora y consecuentemente aparece el efecto de alineamiento neto dando lugar a un momento dipolar neto P por unidad de volumen. La deducción de la forma general de computar esta polarización neta, generalmente se realiza asumiendo primero un grupo de dipolos distribuidos de manera arbitraria, sin un campo externo, y que una cantidad de ellos están distribuidos con un rango de orientaciones angulares determinadas. Si estos están sometidos a un campo eléctrico externo las orientaciones ya no son igualmente probables, y se demuestra por mecánica estadística que el número de moléculas que posee un determinado valor de U, es proporcional a
Teoría de Kirkwood-FrohlichEn esta representación el material es considerado como una colección de dipolos permanentes, sumergidos en un continuo con una constante dieléctrica de alta frecuencia. El momento dipolar efectivo de cada dipolo se incrementa por el valor de fase debido a la polarización por la reacción del campo
donde Categoría: Fisicoquímica |
|
| Este articulo se basa en el articulo Dipolos_permanentes publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |

Último visto

Enciclopedia




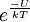 , donde U depende del campo eléctrico total y del ángulo de orientación, por tanto, la forma general de la relación de Langevin es:
, donde U depende del campo eléctrico total y del ángulo de orientación, por tanto, la forma general de la relación de Langevin es:
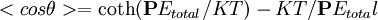
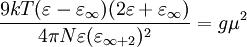
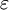 es la constante dieléctrica del material, N es el número de densidad,
es la constante dieléctrica del material, N es el número de densidad, 