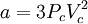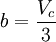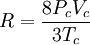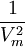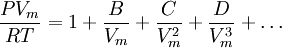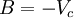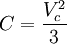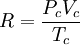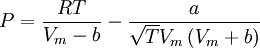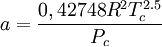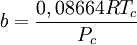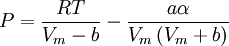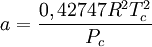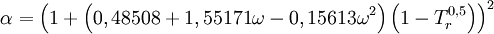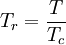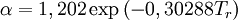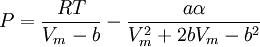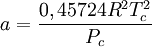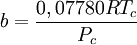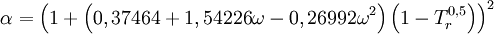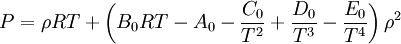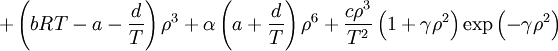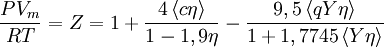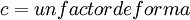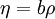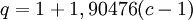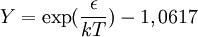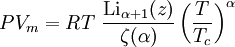|
En física y química, una ecuación de estado es una ecuación constitutiva para sistemas hidrostáticos que describe el estado de agregación de la materia como una relación funcional entre la temperatura, la presión, el volumen, la densidad, la energía interna y posiblemente otras funciones de estado asociadas con la materia. Las ecuaciones de estado son útiles para describir las propiedades de los fluidos, mezclas, sólidos o incluso del interior de las estrellas. Cada substancia o sistema hidrostático tiene una ecuación de estado característica dependiente de los niveles de energía moleculares y sus energías relativas, tal como se deduce de la mecánica estadística. El uso más importante de una ecuación de estado es para predecir el estado de gases y líquidos. Una de las ecuaciones de estado más simples para este propósito es la ecuación de estado del gas ideal, que es aproximable al comportamiento de los gases a bajas presiones y temperaturas mayores a la temperatura crítica. Sin embargo, esta ecuación pierde mucha exactitud a altas presiones y bajas temperaturas, y no es capaz de predecir la condensación de gas en líquido. Por ello, existe una serie de ecuaciones de estado más precisas para gases y líquidos. Entre las ecuaciones de estado más empleadas sobresalen las ecuaciones cúbicas de estado. De ellas, las más conocidas y utilizadas son la ecuación de Peng-Robinson (PR) y la ecuación de Redlich-Kwong-Soave (RKS). Hasta ahora no se ha encontrado ninguna ecuación de estado que prediga correctamente el comportamiento de todas las sustancias en todas las condiciones. Además de predecir el comportamiento de gases y líquidos, también hay ecuaciones de estado que predicen el volumen de los sólidos, incluyendo la transición de los sólidos entre los diferentes estados cristalinos. Hay ecuaciones que modelan el interior de las estrellas, incluyendo las estrellas de neutrones. Un concepto relacionado es la ecuación de estado del fluido perfecto, usada en Cosmología. Producto destacado
Ecuaciones de estado más usadasEn las siguientes ecuaciones las variables están definidas como aparece a continuación; se puede usar cualquier sistema de unidades aunque se prefieren las unidades del Sistema Internacional de Unidades:
Ley del gas idealLa ley de los gases ideales puede escribirse Además, puede expresarse de este modo donde ρ es la densidad, γ el índice adiabático y u la energía interna. Esta expresión está en función de magnitudes intensivas y es útil para simular las ecuaciones de Euler dado que expresa la relación entre la energía interna y otras formas de energía (como la cinética), permitiendo así simulaciones que obedecen a la Primera Ley. Ecuación de Van der Waals
En esta expresión, a, b y R son constantes que dependen de la sustancia en cuestión. Pueden calcularse a partir de las propiedades críticas de este modo: Nótese que Vc se refiere al volumen crítico molar en estas tres últimas ecuaciones. Propuesta en 1873, la ecuación de Van der Waals fue una de las primeras que describía el comportamiento de los gases visiblemente mejor que la ley del gas ideal. En esta ecuación a se denomina el parámetro de atracción y b el parámetro de repulsión o el volumen molar efectivo. Mientras que la ecuación es muy superior a la ley del gas ideal y predice la formación de una fase líquida, sólo concuerda con los datos experimentales en las condiciones en las que el líquido se forma. Mientras que la ecuación de Van der Waals se suele apuntar en los libros de texto y en la documentación por razones históricas, hoy en día está obsoleta. Otras ecuaciones modernas sólo un poco más difíciles son mucho más precisas. La ecuación de Van der Waals puede ser considerada como la "ley del gas ideal mejorada", por las siguientes razones:
Ecuación del VirialAunque generalmente no es la ecuación de estado más conveniente, la ecuación del Virial es importante dado que puede ser obtenida directamente por mecánica estadística. Si se hacen las suposiciones apropiadas sobre la forma matemática de las fuerzas intermoleculares, se pueden desarrollar expresiones teóricas para cada uno de los coeficientes. En este caso B corresponde a interacciones entre pares de moléculas, C a grupos de tres, y así sucesivamente. Ecuación de Redlich-Kwong
Introducida en 1949, la ecuación de Redlich-Kwong fue una mejora considerable sobre las otras ecuaciones de la época. Aún goza de bastante interés debido a su expresión relativamente simple. Aunque es mejor que la ecuación de Van der Waals, no da buenos resultados sobre la fase líquida y por ello no puede usarse para calcular precisamente los equilibrios líquido-vapor. Sin embargo, puede usarse conjuntamente con expresiones concretas para la fase líquida en tal caso. La ecuación de Redlich-Kwong es adecuada para calcular las propiedades de la fase gaseosa cuando el cociente entre la presión y la presión crítica es menor que la mitad del cociente entre la temperatura y la temperatura crítica. Ecuación de Soave
en donde ω es el factor acéntrico del compuesto. para el hidrógeno: En 1972 Soave reemplazó el término a/√(T) de la ecuación de Redlich-Kwong por una expresión α(T,ω) función de la temperatura y del factor acéntrico. La función α fue concebida para cuadrar con los datos de las presiones de vapor de los hidrocarburos; esta ecuación describe acertadamente el comportamiento de estas sustancias. Ecuación de Peng-Robinson
Donde ω es el factor acéntrico del compuesto. La ecuación de Peng-Robinson fue desarrollada en 1976 para cumplir los siguientes objetivos:
Generalmente la ecuación de Peng-Robinson da unos resultados similares a la de Soave, aunque es bastante mejor para predecir las densidades de muchos compuestos en fase líquida, especialmente los apolares. Ecuación de BWRS
Los valores de los parámetros para quince sustancias pueden encontrarse en: K.E. Starling, Fluid Properties for Light Petroleum Systems. Gulf Publishing Company (1973). Elliott, Suresh, DonohueLa ecuación de estado de Elliott, Suresh, y Donohue (ESD) fue propuesta en 1990. Pretende corregir una desviación de la ecuación de estado de Peng-Robinson, en la cual existe una imprecisión en el término de repulsión de van der Waals. La ecuación tiene en cuenta el efecto de la forma de las moléculas apolares y puede extenderse a polímeros añadiendo un término extra (no se muestra). La ecuación fue desarrollada a partir de simulaciones informáticas y comprende la física esencial del tamaño, forma y puente de hidrógeno.
Donde: Bibliografía: Elliott & Lira, Introductory Chemical Engineering Thermodynamics, 1999, Prentice Hall. Ecuación de Bose idealLa ecuación de estado para un gas de Bose ideal es donde α es un exponente específico del sistema (por ejemplo, en ausencia de un campo de potencia, α=3/2), z es exp(μ/kT) donde μ es el potencial químico, Li es el polilogaritmo, ζ es la función zeta de Riemann y Tc es la temperatura crítica a la cual el condensado de Bose-Einstein empieza a formarse. Véase también
|
|
| Este articulo se basa en el articulo Ecuación_de_estado publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |





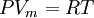
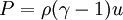
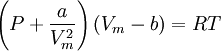 , nótese que Vm es el volumen molar.
, nótese que Vm es el volumen molar.