|
La energía reticular o energía de red es la energía necesaria para separar completamente un mol de un compuesto iónico sólido en sus iones en estado gaseoso. No es posible medir la energía reticular directamente. Sin embargo, si se conoce la estructura y composición de un compuesto iónico, puede calcularse mediante la Ley de Coulomb. También puede ser calculada a partir del ciclo de Born-Haber. Su fórmula es: Producto destacadoDonde Na es el número de Avogadro, A la constante de Madelung, que varía depiendo de la estructura del compuesto iónico, Z + la carga del catión y Z − la carga del anión, q la carga del electrón, ε0 la permitividad del vacío, d0 la distancia entre el anión y el catión y n los exponentes de Bohr.
UnidadesLa energía reticular tiene la misma magnitud que la entalpía estándar ΔHo, pero de signo contrario, es decir:
Véase tambiénCategoría: Química |
| Este articulo se basa en el articulo Energía_reticular publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |

Último visto

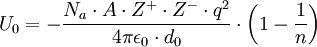



 Es muy importante tener en cuenta este concepto para las reacciones químicas.
Es muy importante tener en cuenta este concepto para las reacciones químicas.


