|
La Geometría molecular o estructura molecular es la disposición tridimensional de los átomos que constituyen una molécula, inferida a partir de estudios espectroscópicos del compuesto químico. La geometría molecular determina varias propiedades de una sustancia, incluyendo su reactividad, polaridad, estado de agregación, color, magnetismo y actividad biológica. Las geometrías moleculares se determinan mejor a temperaturas próximas al cero absoluto porque a temperaturas más altas las moléculas presentarán un movimiento rotacional considerable. En el estado sólido la geometría molecular puede ser medida por Difracción de rayos X. Las geometrías se pueden calcular por procedimientos mecánico cuánticos ab initio o por métodos semiempíricos de modelamiento molecular. Las moléculas grandes a menudo existen en múltiples conformaciones estables que difieren en su geometría molecular y están separadas por barreras altas en la superficie de energía potencial. La posición de cada átomo se determina por la naturaleza de los enlaces químicos con los que se conecta a sus átomos vecinos. La geometría molecular puede describirse por las posiciones de estos átomos en el espacio, mencionando la longitud de enlace de dos átomos unidos, ángulo de enlace de tres átomos conectados y ángulo de torsión de tres enlaces consecutivos. Conocimientos adicionales recomendados
La influencia de la excitación térmicaDado que el movimiento de los átomos en una molécula está determinado por la mecánica cuántica, uno debe definir el "movimiento" de una manera cuántica. Los movimientos cuánticos (externos) de traslación y rotación cambian fuertemente la geometría molecular. (En algún grado la rotación influye en la geometría por medio de la fuerza de Coriolis y la distorsión centrífuga, pero son despreciables en la presente discusión). Un tercer tipo de movimiento es la vibración, un movimiento interno de los átomos en una molécula. Las vibraciones moleculares son armónicas (al menos en una primera aproximación), lo que significa que los átomos oscilan en torno a su posición de equilibrio, incluso a la temperatura del cero absoluto. En el cero absoluto todos los átomos están en su estado vibracional basal y muestran movimiento mecánico cuántico de punto cero, esto es, la función de onda de un modo vibracional simple no es un pico agudo, sino un exponencial de ancho finito. A temperaturas mayores, los modos vibracionales pueden ser excitados térmicamente (en un interpretación clásica, esto se expresa al enunciar que "las moléculas vibrarán más rápido"), pero siempre oscilan alrededor de una geometría reconocible para la molécula. Para tener una comprensión más clara de la probabilidad de que la vibración de una molécula pueda ser térmicamente excitada, se inspecciona el factor de Boltzmann Como se mencionó anteriormente, la rotación influye fuertemente sobre la geometría molecular. Pero, como movimiento mecánico cuántico, se excita a bajas temperaturas (comparada con la vibración). Desde un punto de vista clásico, puede decirse que más moléculas rotan más rápidamente a temperatura ambiente, esto es que tienen mayor velocidad angular y momentum angular. En lenguaje de mecánica cuántica: más "eigenstates" de alto momentum angular son poblados térmicamente al aumentar la temperatura. Las energías de excitación rotacionales típicas están en el orden de unos pocos cm-1. Los resultados de muchos experimentos espectroscópicos están ensanchados porque involucran una media de varios estados rotacionales. Frecuentemente es difícil obtener las geometrías a partir de los espectros a altas temperaturas, porque el número de estados rotacionales rastreados en el experimento aumenta al incrementarse la temperatura. En consecuencia, muchas observaciones espectroscópicas sólo puede esperarse que conduzcan a geometrías moleculares confiables a temperaturas cercanas al cero absoluto, porque a altas temperaturas, hay demasiados estados rotacionales térmicamente poblados. EnlazamientoPor definición, los átomos en las moléculas suelen estar unidos unos a otros con enlaces covalentes, que involucran a enlaces simples, dobles o triples, donde un "enlace" es un par de electrones compartidos (la otra forma de unión entre átomos se denomina enlace iónico e involucra a cationes (iones positivos), y aniones (iones negativos). La geometría molecular puede ser especificada en términos de longitud de enlace, ángulo de enlace y ángulo torsional. La longitud de enlace está definida como la distancia media entre los centros de dos átomos enlazados en una moléculada dada. Un ángulo de enlace es el ángulo formado por tres átomos enlazados consecutivamente. Para cuatro átomos unidos consecutivamente en una cadena linea, el ángulo torsional es el ángulo entre el plano formado por los tres primeros átomos y el plano formado por los tres últimos átomos. IsómerosLos isómeros son tipos de moléculas ue comparten la misma fórmula química, pero que tienen diferentes geometrías, resultando en propiedades muy distintas:
Tipos de estructura molecular
ReferenciasCategoría: Química |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Geometría_molecular publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




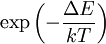 , donde
, donde 