Glicosilfosfatidilinositol diacilglicerol-liasa
| Glicosilfosfatidilinositol diacilglicerol-liasa
|
| Identificadores
|
| Símbolo
| GPI-PLC
|
| Símbolos alt.
| PHLC_TRYBB
|
| PDB
| ?
|
| UniProt
| P09194
|
| Otros datos
|
| Número EC
| 4.6.1.14
|
En enzimología, una glicosilfosfatidilinositol diacilglicerol-iasa (EC 4.6.1.14) es una enzima en membranas de tripanosomas y algunas bacterias, con actividad en adipocitos de ratones,[1] que cataliza la reacción química:
- 6-(α-D-glucosaminil)-1-fosfatidil-1D-mio-inositol
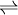 6-(α-D-glucosaminil)-1D-mio-inositol 1,2-fosfato cíclico + 1,2-diacil-sn-glicerol 6-(α-D-glucosaminil)-1D-mio-inositol 1,2-fosfato cíclico + 1,2-diacil-sn-glicerol
La enzima y la reacción que cataliza es muy similar a la de la fosfolipasa C bacteriana,[2] por lo tanto, esta enzima tiene un solo sustrato: 6-(α-D-glucosaminil)-1-fosfatidil-1D-mio-inositol y dos únicos productos.
Etimología
Esta enzima pertenece a la familia de las liasas, especificamente a la clase de liasas de fósforo y oxígeno. El nombre sistemático de la enzima es 6-(α-D-glucosaminil)-1-fosfatidil-1D-mio-inositol formadora de 6-(α-D-glucosaminil)-1D-mio-inositol 1,2-fosfato cíclico + 1,2-diacil-sn-glicerol. Otros nombres usados en la literatura incluyen:
- Fosfolipasa C (glicosil)fosfatidilinositol específica,
- Fosfolipasa C GPI específica,
- Lipasa de la glicoproteína variante de superficie (VSG, por sus siglas en inglés variant-surface-glycoprotein),
- Enzima hidrolizante del anclaje fosfolipídico glicosil inositol,
Función
La enzima es una liasa que produce la ruptura de proteínas del glicosilfosfatidilinositol (GPI) en las membranas plasmáticas. La única enzima categorizada de este tipo es producida por el protista Trypanosoma brucei.[3] La enzima actúa también como una lipasa de ciertas glicoproteínas en la superficie de la membrana, junto con una proteasa TbMSP-B, con el fin de permitir al parásito poder sobrevivir en el torrente sanguíneo de las moscas tsetse (Glossina spp.).[4]
La T. brucei también produce una fosfolipasa A cuyo sustrato es la fosfatidilcolina (GPCho).[5]
Referencias
- ↑ Müller G, Schulz A, Wied S, Frick W. Regulation of lipid raft proteins by glimepiride- and insulin-induced glycosylphosphatidylinositol-specific phospholipase C in rat adipocytes. Biochem Pharmacol. 2005 Mar 1;69(5):761-80. (en inglés). Último acceso 21 de marzo, 2008.
- ↑ Mark Carrington, Nicola Carnall, Mandy S. Crow, Anne Gaud, Maria B. Redpath, Christine L. Wasunna y Helena Webb. The properties and function of the glycosylphosphatidylinositol-phospholipase C in Trypanosoma brucei (en inglés). Último acceso 21 de marzo, 2008. Molecular and Biochemical Parasitology; Volume 91, Issue 1, 1 March 1998, Pages 153-164
- ↑ IUBMB Enzyme Nomenclature. EC 4.6.1.14 (en inglés). Último acceso 21 de marzo, 2008.
- ↑ Grandgenett PM, Otsu K, Wilson HR, Wilson ME, Donelson JE. A function for a specific zinc metalloprotease of African trypanosomes (en inglés). PLoS Pathog. 2007 Oct 19;3(10):1432-45. Último acceso 21 de marzo, 2008.
- ↑ RICHMOND Gregory S.; SMITH Terry K. A novel phospholipase from Trypanosoma brucei (en inglés). Molecular microbiology (Mol. microbiol.) ISSN 0950-382X; (2007) vol. 63, no4, pp. 1078-1095. Último acceso 21 de marzo, 2008.
Bibliografía
- Hereld D, Krakow JL, Bangs JD, Hart GW, Englund PT (1986). "A phospholipase C from Trypanosoma brucei which selectively cleaves the glycolipid on the variant surface glycoprotein". J. Biol. Chem. 261: 13813–9.
- Carnall N, Webb H, Carrington M (1997). "Mutagenesis study of the glycosylphosphatidylinositol phospholipase C of Trypanosoma brucei". Mol. Biochem. Parasitol. 90: 423–32.
- Armah DA, Mensa-Wilmot K (2000). "Tetramerization of glycosylphosphatidylinositol-specific phospholipase C from Trypanosoma brucei". J. Biol. Chem. 275: 19334–42.
|


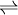 6-(α-D-glucosaminil)-1D-mio-inositol 1,2-fosfato cíclico + 1,2-diacil-sn-glicerol
6-(α-D-glucosaminil)-1D-mio-inositol 1,2-fosfato cíclico + 1,2-diacil-sn-glicerol





