|
En óptica, la ley de Beer-Lambert, también conocida como ley de Beer o ley de Beer-Lambert-Bouguer es una relación empírica que relaciona la absorción de luz con las propiedades del material atravesado. Conocimientos adicionales recomendados
Ecuaciones
Esto se puede expresar de distintas maneras: Dónde:
En resumen, la ley explica que hay una relación exponencial entre la transmisión de luz a través de una sustancia y la concentración de la sustancia, así como también entre la transmisión y la longitud del cuerpo que la luz atraviesa. Si conocemos l y α, la concentración de la sustancia puede ser deducida a partir de la cantidad de luz transmitida. Las unidades de c y α dependen del modo en que se exprese la concentración de la sustancia absorbente. Si la sustancia es líquida, se suele expresar como una fracción molar. Las unidades de α son la inversa de la longitud (por ejemplo cm-1). En el caso de los gases, c puede ser expresada como densidad (la longitud al cubo, por ejemplo cm-3), en cuyo caso α es una sección representativa de la absorción y tiene las unidades en longitud al cuadrado (cm2, por ejemplo). Si la concentración de c está expresada en moles por volumen, α es la absorbencia molar normalmente dada en mol cm-2. El valor del coeficiente de absorción α varía según los materiales absorbentes y con la longitud de onda para cada material en particular. Se suele determinar experimentalmente. La ley tiende a no ser válida para concentraciones muy elevadas, especialmente si el material dispersa mucho la luz. La relación de la ley entre concentración y absorción de luz está basada en el uso de espectroscopía para identificar sustancias. Ley de Beer-Lambert en la atmósferaEsta ley también se aplica para describir la atenuación de la radiación solar al pasar a través de la atmosfera. En este caso hay dispersión de la radiación además de absorción. La ley de Beer-Lambert para la atmosfera se suele expresar
donde cada kx es un coeficiente de extinción cuyo subíndice identifica la fuente de absorción o dispersión:
HistoriaLa ley de Beer fue descubierta independientemente (y de distintas maneras) por Pierre Bouguer en 1729, Johann Heinrich Lambert en 1760 y August Beer en 1852. Véase también
Categoría: Espectroscopía |
|
| Este articulo se basa en el articulo Ley_de_Beer-Lambert publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




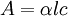
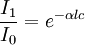
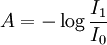
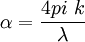
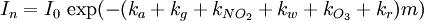 ,
,
