|
Las leyes que describen la electrólisis son: Conocimientos adicionales recomendados1) El cambio químico producido en la electrólisis es proporcional a la carga de electricidad que pasa por la celda.
La LeyLa ley de Faraday en la forma moderna: donde:
Categoría: Química |
| Este articulo se basa en el articulo Ley_de_Faraday_de_la_electrólisis publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




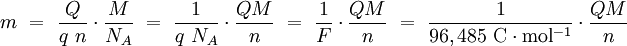
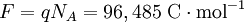 es la
es la 