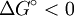|
Una reacción Exergónica es una reacción química donde la variación de la energía libre de Gibbs es negativa.[1] Esto nos indica la dirección que la reacción seguirá. A temperatura y presión, constantes una reacción exergónica se define con la condición: Producto destacadoQue describe una reacción química que libera energía en forma de calor, luz, etc. Las reacciones exergónicas son una forma de procesos exergonicos en general o procesos espontáneos y son lo contrario de las reacciones endergónicas. Se dijo que las reacciones exergónicas trancurren espontáneamente pero esto no significa que la reacción transcurrirá sin ninguna limitación. Por ejemplo la reacción entre hidógeno y oxigeno es muy lenta y no se observa en ausencia de un catalizador adecuado. Puntos clave
Enlaces externos
Categoría: Termoquímica |
| Este articulo se basa en el articulo Reacción_exergónica publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |

Último visto