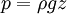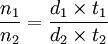|
El líquido es uno de los tres estados de agregación de la materia, un líquido es un fluido cuyo volumen es constante en condiciones de temperatura y presión constante y su forma es esférica. Sin embargo, debido a la gravedad ésta queda definida por su contenedor. Un líquido ejerce presión en el contenedor con igual magnitud hacia todos los lados. Si un líquido se encuentra en reposo, la presión que ejerce esta dada por: Conocimientos adicionales recomendadosDonde ρ es la densidad del líquido y z es la distancia del punto debajo de la superficie. Los líquidos presentan tensión superficial y capilaridad, generalmente se expanden cuando se incrementa su temperatura y se comprimen cuando se enfrían. Los objetos inmersos en algún líquido son sujetos a un fenómeno conocido como flotabilidad. Las moléculas en el estado líquido ocupan posiciones al azar que varían con el tiempo. Las distancias intermoleculares son constantes dentro de un estrecho margen. Cuando un líquido sobrepasa su punto de ebullición cambia su estado a gaseoso, y cuando alcanza su punto de congelación cambia a sólido. Por medio de la destilación fraccionada, los líquidos pueden separarse de entre sí al evaporarse cada uno al alcanzar sus respectivos puntos de ebullición. La cohesión entre las moléculas de un líquido no es lo suficientemente fuerte por lo que las moléculas superficiales se pueden evaporar. Líquidos, sustancias en un estado de la materia intermedio entre los estados sólido y gaseoso. Las moléculas de los líquidos no están tan próximas como las de los sólidos, pero están menos separadas que las de los gases. En algunos líquidos, las moléculas tienen una orientación preferente, lo que hace que el líquido presente propiedades anisótropas (propiedades, como el índice de refracción, que varían según la dirección dentro del material). En condiciones apropiadas de temperatura y presión, la mayoría de las sustancias puede existir en estado líquido. A presión atmosférica, sin embargo, algunos sólidos se subliman al calentarse; es decir, pasan directamente del estado sólido al estado gaseoso (véase Evaporación). La densidad de los líquidos suele ser algo menor que la densidad de la misma sustancia en estado sólido. Algunas sustancias, como el agua, son más densas en estado líquido. ViscosidadLos líquidos se caracterizan por una resistencia al flujo llamada viscosidad. La viscosidad de un líquido crece al aumentar el número de moles y disminuye al crecer la temperatura. La viscosidad también está relacionada con la complejidad de las moléculas que constituyen el líquido: es baja en los gases inertes licuados y alta en los aceites pesados. Es una propiedad característica de todo fluìdo (lìquidos o gases). La viscosidad es una medida de la resistencia al desplazamiento de un fluìdo cuando existe una diferencia de presión. Cuando un lìquido o un gas fluyen se supone la existencia de una capa estacionaria, de lìquido o gas, adherida sobre la superficie del material a travès del cual se presenta el flujo. La segunda capa roza con la adherida superficialmente y èsta segunda con una tercera y así sucesivamente. Este roce entre las capas sucesivas es el responsable de la oposición al flujo o sea el responsable de la viscosidad. La viscosidad se mide en poise, siendo un poise la viscosidad de un lìquido en el que para deslizar una capa de un centìmetro cuadrado de àrea a la velocidad de 1 cm/s respecto a otra estacionaria situado a 1 cm de distancia fuese necesaria a la fuerza de una dina. La viscosidad suele decrecer en los liquidos al aumentar la temperatura, aunque algunos pocos lìquidos presentan un aumento de viscosidad cuando se calientan. Para los gases la viscosidad aumenta al aumentar la temperatura. La viscosidad de un liquido se determina por medio de un viscosímetro entre los cuales el más utilizado es el de Ostwald, este se utiliza para determinar viscosidad relativas, es decir, que conociendo la viscosidad de un líquido patrón, generalmente agua, se obtiene la viscosidad del líquido problema a partir de la ecuación:
Presión de vapor y otros parámetrosLa presión de un vapor en equilibrio con su forma líquida, la llamada presión de vapor, sólo depende de la temperatura; su valor a una temperatura dada es una propiedad característica de cada líquido. También lo son el punto de ebullición, el punto de solidificación y el calor de vaporización (esencialmente, el calor necesario para transformar en vapor una determinada cantidad de líquido). En ciertas condiciones, un líquido puede calentarse por encima de su punto de ebullición; los líquidos en ese estado se denominan supercalentados. También es posible enfriar un líquido por debajo de su punto de congelación y entonces se denomina líquido superenfriado. Véase también
Categoría: Estados de la materia |
| Este articulo se basa en el articulo Líquido publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia