|
Un ácido débil es aquel ácido que no está totalmente disociado en una disolución acuosa. Aporta iones H + al medio, pero también es capaz de aceptarlos. Si representáramos el ácido con la fórmula general HA, en una disolución acuosa una cantidad significativa de HA permanece sin disociar, mientras que el resto del ácido se disociará en iones positivos H + y negativos A − , formando un equilibrio ácido-base en la siguiente forma: 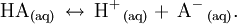 Conocimientos adicionales recomendadosLas concentraciones en equilibrio de reactivos y productos se relacionan mediante la constante de acidez (Ka), cuya expresión es: ![\mathrm{ K_a\, =\, \frac {[H^+\,][A^-\,]}{[HA]} }](images/math/e/1/1/e1160cb29e6e647fa04612aee2af4f35.png) Cuanto mayor es el valor de Ka, más se favorece la formación de iones H + , y más bajo es el pH de la disolución. La Ka de los ácidos débiles varía entre 1,80×10-16 y 55,50. Los ácidos con una constante Ka menor de 1,80×10-16 son ácidos más débiles que el agua. Los ácidos con una constante Ka de más de 55,50 se consideran ácidos fuertes y se disocian casi en su totalidad cuando son disueltos en agua. La gran mayoría de los ácidos son débiles. Entre ellos, casi todos los ácidos orgánicos. Pueden considerarse ácidos débiles:
Véase también
Categoría: Ácidos |
| Este articulo se basa en el articulo Ácido_débil publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




