|
La ecuación de Van't Hoff en termodinámica química relaciona la variación de la temperatura (T) con la variación de la constante de equilibrio (K) dado por la diferencia de entalpía (ΔH). Esta ecuación fue propuesta inicialmente por Jacobus Henricus van 't Hoff. Conocimientos adicionales recomendadosSi se asume que el calor de reacción no varía con la temperatura, la resolución de esta ecuación diferencial conduce a lo siguiente: En esta ecuación Considerando las relaciones entre la energía libre de Gibbs y la constante de equilibrio ( Por tanto, al representar valores de logaritmo natural de la constante de equilibrio medidos para cierto equilibrio versus el inverso de la temperatura se obtiene una línea recta, cuya pendiente negativa es igual a la variación de la entalpía dividida entre la constante de los gases, y la ordenada en el origen es igual a la variación de entropía Categoría: Termoquímica |
| Este articulo se basa en el articulo Ecuación_de_Van't_Hoff publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia

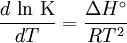



![\ln \left( {\frac{{K_2 }}{{K_1 }}} \right) = \frac{{ \Delta H^\circ }}{R}\left[ {\frac{1}{{T_1 }} - \frac{1}{{T_2 }}} \right]](images/math/b/5/7/b57a8989b82779b35a96c28e17c650f0.png)
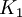 es la constante de equilibrio a la
es la constante de equilibrio a la 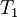 y
y 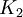 es la constante de equilibrio a la temperatura absoluta
es la constante de equilibrio a la temperatura absoluta 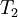 .
. 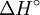 es la variación de entalpía y
es la variación de entalpía y 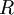 es la
es la 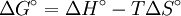 y
y 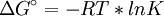 ), la ecuación también se podría escribir de la siguiente manera:
), la ecuación también se podría escribir de la siguiente manera:
![\ln \left( K \right) = - \frac{{\Delta H^\circ }}{R}\left[ {\frac{1}{{T }}}\right] + \frac{{\Delta S^\circ }}{R}](images/math/0/8/0/080feb6c106bd4023223d212dedc79de.png)
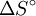 dividida entre la constante de los gases.
dividida entre la constante de los gases.
