|
Un Hartree (símbolo Eh) es la unidad atómica de energía, llamada así por el físico Douglas Hartree. Producto destacadoLa energía de Hartree es igual al valor absoluto de la energía potencial eléctrica del átomo de hidrógeno en su estado fundamental. Este valor es exáctamente el doble del valor absoluto de la energía de enlace del electrón en el estado fundamental del átomo de hidrógeno, |E1| (no es exáctamente igual a dos veces la energía de ionización debido a la masa finita del protón; véase masa reducida).
donde:
Categoría: Constantes físicas |
| Este articulo se basa en el articulo Hartree publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




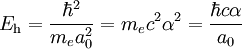
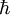 es la
es la 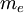 es la masa en reposo del
es la masa en reposo del 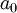 es el
es el 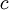 es la
es la 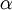 es la
es la