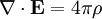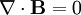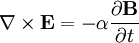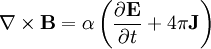|
Las Unidades Atómicas (au) forman un sistema de unidades conveniente para la física atómica, electromagnetismo, mecánica y electrodinámica cuánticas, especialmente cuando nos interesamos en las propiedades de los electrones. Hay dos tipos diferentes de unidades atómicas, denominadas unidades atómicas de Hartree y unidades atómicas de Rydberg, que difieren en la elección de la unidad de masa y carga. En este artículo trataremos sobre las unidades atómicas de Hartree. En au, los valores numéricos de las siguientes seis constantes físicas se definen como la unidad:
Conocimientos adicionales recomendados
Unidades fundamentales
Estas seis unidades no son independientes; para normalizarlas simultáneamente a 1, es suficiente con normalizar cuatro de ellas a 1. La normalización de la energía de Hartree y de la constante de Coulomb, por ejemplo, son una consecuencia de normalizar las otras cuatro magnitudes. Análisis dimensionalPara comprobar, por ejemplo, como la normalización de la energía de Hartree y del Bohr son consecuencia de normalizar la masa y carga del electrón y las constantes de Planck y de Coulomb, podemos utilizar el análisis dimensional. Así, si consideramos las dimensiones del operador energía cinética en unidades del Sistema Internacional, tenemos que el Hartree se puede expresar como Análogamente, si consideramos las dimensiones del operador energía potencial, tendremos
Si igualamos ambas expresiones, podemos obtener la relación del Bohr con las otras cuatro unidades
Por último, sustituyendo a0 en cualquiera de las expresiones de Eh, se obtiene la definición del Hartree en términos de las constantes fundamentales
Algunas unidades derivadas
Comparación con las unidades de PlanckTanto las unidades de Planck como las unidades atómicas derivan de algunas propiedades fundamentales del mundo físico, libres de consideraciones antropocéntricas. Para facilitar la comparación entre los dos sistemas de unidades, las tablas anteriores muestran los órdenes de magnitud, en unidades del SI, de la unidad de Planck correspondiente a cada unidad atómica. Generalmente, cuando una unidad atómica es "grande" en términos del SI, la coorespondiente unidad de Planck es "pequeña", y viceversa. Conviene tener en cuenta que las unidades atómicas se han diseñado para cálculos a escala atómica en el Universo actual, mientras que las Unidades de Planck son más adecuadas para la gravedad cuántica y la cosmología del Universo primitivo. Tanto las "unidades atómicas" como las unidades de Planck normalizan la constante de Dirac a 1. Más aun, las unidades de Planck normalizan a 1 las dos constantes de la relatividad general y cosmología: la constante gravitacional G y la velocidad de la luz en el vacío, c. Si denotamos por α la constante de estructura fina, el valor de c en unidades atómicas es α-1 ≈ 137.036. Las unidades Atómicas, por contra, normalizan a 1 la masa y carga del electrón, y a0, el radio de Bohr del átomo de hidrógeno. Normalizar a0 a 1 implica normalizar la constante de Rydberg, R∞, a 4π/α = 4πc. Dado en unidades atómicas, el magnetón de Bohr sería μB=1/2, mientras que el correspondiente valor en unidades de Planck es e/2me. Finalmente, las unidades atómicas normalizan a 1 la unidad de energía atómica, mientras que las unidades de Planck normalizan a 1 la constante de Boltzmann k, que relaciona energía y temperatura. Mecánica y electrodinámica cuánticas simplificadasLa ecuación de Schrödinger dependiente del tiempo (no-relativista) para un electrón en unidades del Sistema Internacional es
La misma ecuación en unidades atómicas es
Para el caso especial de un electrón entorno a un protón, el Hamiltoniano en unidades del Sistema Internacional es
mientras que en unidades atómicas esta ecuación se transforma en
Por último, las ecuaciones de Maxwell toman la siguiente forma elegante cuando se expresan en unidades atómicas: (Realmente hay una ambigüedad a la hora de definir las unidades atómicas del campo magnético. Las ecuaciones de Maxwell anteriores utilizan la convención "Gaussiana", en la que una onda plana tiene un campo eléctrico y magnético de igual magnitud. En la convención de la "fuerza de Lorentz", el factor α se incluye en B.) Véase también
Enlaces externos
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Unidades_atómicas publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Enciclopedia




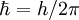
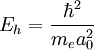
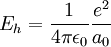 ,
,
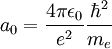 .
.
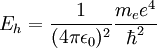 .
.
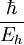
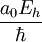
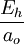
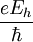
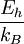
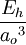
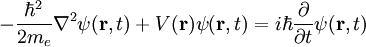 .
.
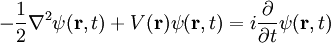 .
.
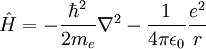 ,
,
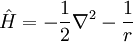 .
.