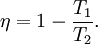|
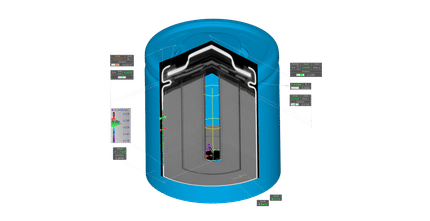
Producto destacadoLa máquina de Carnot es una máquina ideal que utiliza calor para realizar un trabajo. En ella hay un gas sobre el que se ejerce un proceso cíclico de expansión y contracción entre dos temperaturas. El ciclo termodinámico utilizado se denomina ciclo de Carnot y fue estudiado por Sadi Carnot alrededor de 1820. Una máquina de Carnot es el procedimiento más eficaz para producir un trabajo a partir de dos focos de temperatura. Puede construirse a partir de un cilindro sobre el que discurre un pistón unido a una biela que convierte el movimiento lineal del pistón en movimiento circular. El cilindro contiene una cierta cantidad de un gas ideal y la máquina funciona intercambiando calor entre dos fuentes de temperaturas constantes T1 < T2. Las transferencias de calor entre las fuentes y el gas se hace isotérmicamante, es decir, manteniendo la temperatura constante. Esta parte del proceso es, por lo tanto, reversible. El ciclo se completa con una expansión y una compresión adiabáticas, es decir, sin intercambio de calor, por lo que esta parte del ciclo es también reversible. Funcionamiento de la Máquina de Carnot
Trabajo realizadoPor la Primera Ley de la Termodinámica, en cada ciclo la máquina realiza un trabajo mecánico dW igual al calor dQ transferido de T2 a T1, lo cual se puede comprobar usando las igualdades obtenidas en cada ciclo:
donde la segunda igualdad se obtiene de 1) y 3). Por otro lado, el estado del gas al terminar un ciclo es el mismo que al comenzarlo, por lo que el cambio de su energía interna debe ser cero:
De esta igualdad y de 1), 2), 3) y 4) se deduce que dW2 + dW4 = 0. Por lo tanto
El rendimiento de una máquina de Carnot (el cociente entre el calor absorbido y el trabajo desempeñado) es máximo y puede calcularse como:
Véase tambiénCategoría: Motores de aire caliente |
| Este articulo se basa en el articulo Máquina_de_Carnot publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |