El coeficiente de dilatación adiabática es la razón entre la capacidad calorífica a presión constante (CP) y la capacidad calorífica a volumen constante(CV). A veces es también conocida como factor de expansión isentrópica y razón de calor específico, y se denota con la expresión γ (gamma) o incluso κ (kappa). El simbolo empleado como kappa es el que aparece más frecuentemente en los libros de ingeniería química antiguos y es por esta razón por la que se deduce que originariamente se empleaba este.
donde el valor de C es el capacidad calorífica o capacidad calorífica específica de un gas, los sufijos P y V se refieren a las condiciones de presión constante y de volumen constante respectivamente. Conocimientos adicionales recomendados
ConceptoPara comprender esta relación entree las capacidades caloríficas a presión y volumen constante se considera el siguiente experimento: Un cilindro cerrado con un pistón bloqueado contiene aire. La presión interior es igual a la presión atmosférica del aire fuera. Este cilindro se calienta. Dado que el pistón no se puede mover, el volumen es constante. La temperatura y la presión aumentarán. La fuente de calor se detiene y la energía añadida al sistema es proporcional a CV. El pistón es liberado y se mueve hacia el exterior, la ampliación del volumen, sin intercambio de calor (adiabático expansión). Al hacer esto trabajo (proporcional a CP) se enfría el aire en el interior del cilindro a la temperatura por debajo de su instante de inicio. Para volver al estado inicial de temperatura (todavía con un pistón libre), el aire debe ser calentado. Este exceso de calor se eleva a cerca del 40% de la cantidad anterior. En el ejemplo anterior, tal vez no fuese evidente cómo CP debido a que está implicado en la ampliación y posterior calentamiento del sistema y durante el proceso la presión no permanece constante. Otra forma de entender la diferencia entre CP y CV consiste en considerar la diferencia entre la adición de calor al gas con un pistón bloqueado, y la adición de calor con un pistón con libertad de movimiento, de manera que la presión se mantiene constante. En este caso, el gas se expandirá por el calor causando que el pistón haga el trabajo mecánico contra la atmósfera. El calor que se añade al gas va sólo en parte en la calefacción de gas; Mientras que el resto se transforma en el trabajo mecánico realizado por el pistón. En el caso de volumen constante (pistón bloqueado) no existe un movimiento externo, y por lo tanto no se realiza el trabajo mecánico en la atmósfera. Así, la cantidad de calor necesaria para elevar la temperatura del gas (la capacidad térmica) es mayor en el caso de una presión constante. Relaciones con un gas idealPara un gas ideal la capacidad calorífica es constante con la temperatura. De acuerdo con esta afirmación la entalpía puede expresarse como H = CPT y la energía interna como U = CVT. Por lo tanto, se puede decir que la capacidad calorífica es el ratio entee la entalpía y la energía interna: De la misma forma, las capacidades caloríficas pueden ser expresadas en términos del ratio ( γ ) y la constante de gas ( R ): Es dificiel encontrar tabulada información sobre CV, y es frecuente encontrar, sin embargo, más fácilmente información tabular sobre CP. La siguiente relación se puede emplear para determinar CV:
Relación con los grados de libertadLa razón de capacidades caloríficas ( γ ) para un gas ideal puede estar relacionado con los grados de libertad ( f ) de una molécula por lo siguiente: Se puede observar que en el caso de un gas monoatómico, con tres grados de libertad:
mientras que en un gas diatómico, con cinco grados de libertad (a temperatura ambiente):
Por ejemplo: la atmósfera terrestre está compuesta principalmente de gases diatómicos (~78% nitrógeno (N2) y ~21% oxígeno (O2)) y a condición estándard puede considerarse como un gas ideal. Una molécula de un gas diatómico posee cinco grados de libertad (tres tranlacionales y dos rotacionales, el grado de libertad vibracional no se tiene en cuenta si no es a grandes temperaturas). con todo ello resulta un valor de
Esto es consistente con las medidas del índice adiabático de aproximadamente de 1.403 (se puede ver en la tabla susodicha). Véase también
Referencias
Categoría: Termodinámica |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Coeficiente_de_dilatación_adiabática publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Enciclopedia

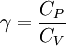



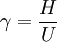
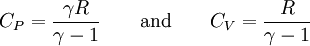
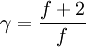
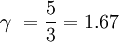 ,
,
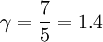 .
.
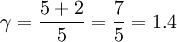 .
.
