|
La exergía es una magnitud termodinámica que indica el máximo trabajo teórico que se puede alcanzar por la interacción espontánea entre el sistema cerrado y entorno. Informa de la utilidad potencial del sistema como fuente de trabajo. Por ejemplo, un sistema aislado compuesto por un combustible y aire, si se quema el combustible obteniendo una mezcla de aire y productos de combustión ligeramente calientes, aunque la energía asociada al sistema sea la misma, la exergía del sistema inicial es mucho mayor, potencialmente es mucho más útil a la hora de obtener trabajo. Otro ejemplo es el agua de refrigeración de las centrales térmicas. Aunque la central cede una gran cantidad de energía al agua, esta solo eleva su temperatura unos grados centígrados por encima de la temperatura de su entorno, por tanto su utilidad potencial para obtener trabajo es prácticamente nula o lo que es lo mismo en términos técnicos, tiene una exergía asociada baja. Conocimientos adicionales recomendados
Estado muertoDos sistemas en condiciones termodinámicas diferentes evolucionarán espontáneamente, por medio de transferencias de masa y energía, hacia un estado intermedio de equilibrio (el que tenga mínima energía y entropía máxima). A este estado de equilibrio se le denomina estado muerto. Cuanto mayor sean las diferencias entre sus magnitudes termodinámicas (presión, temperatura..) más trabajo podremos obtener de la interacción entre sistema y entorno.
Expresión matemáticaLa exergía (Availability en inglés) se define como A = (E − U0) + p0(V − V0) − T0(S − S0) donde E representa la energía del sistema, suma de la energía interna (U) más la cinética y potencial. V u S son el volumen y la entropía del sistema, p es la presión del sistema. El subíndice 0 se utiliza para designar el valor que alcanzarían estas magnitudes si se deja interactuar libremente al sistema y el entorno, hasta alcanzar el equilibrio termodinámico (estado muerto). Aunque se trata de una magnitud extensiva, a menudo resulta útil trabajar con sus valores específicos, exergía por unidad de masa o mol. A = (e − u0) + p0(v − v0) − T0(s − s0). Fijarse que para la expresión de los balances se utiliza el criterio de signos termodinámico. BalancesEn realidad un balance de exergía no es más que la combinación de un balance de energía y de entropía, que derivan a su vez del primer y segundo principio de la termodinámica. No es por tanto un resultado independiente, pero puede utilizarse como formulación alternativa de la segunda ley de la termodinámica. Como alternativa al principio de incremento de entropía, se puede formular la segunda ley estableciendo que, los únicos procesos que puede experimentar un sistema aislado son aquellos en los que la exergía del sistema disminuye. Balance en sistemas cerradosUn sistema cerrado puede interaccionar con el entorno mediante transferencias de energía en forma de calor o trabajo, que implican una transferencia de exergía entre el sistema y el entorno. Esta exergía transferida no coincide necesariamente con la variación de exergía del sistema, ya que la exergía también se destruye como consecuencia de la generación de entropía (todos los procesos reales con transferencia de energía en forma de calor conllevan, además de una transferencia de entropía, una generación de entropía debida a procesos irreversibles dentro del sistema.
La variación de exergía del sistema cerrado es igual a la transferencia de exergía con el entorno, menos la destrucción de exergía T0σ, donde σ representa la generación de entropía, que por el segundo principio, no puede ser negativa. Balance en sistemas abiertosPara sistemas abiertos, en los que hay transferencia de masa, se maneja el concepto de exergía de flujo, que no es más que la exergía asociada a una corriente material que atraviesa un volumen de control determinado. Adaptando la expresión y utilizando magnitudes específicas (por unidad de masa) se tiene:
El balance de exergía en un sistema abierto como:
Esto es, la variación de exergía acumulada dentro del sistema por unidad de tiempo es igual a: Que el término Véase también:
Referencias
Véase tambiénEconomía ecológica Enlaces externos
Categoría: Magnitudes termodinámicas |
|
| Este articulo se basa en el articulo Exergía publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




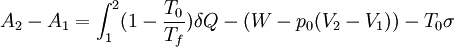
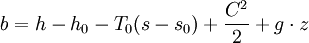 donde h, s, C, y z son entalpía, entropía, velocidad, altura del flujo respectivamente.
donde h, s, C, y z son entalpía, entropía, velocidad, altura del flujo respectivamente. 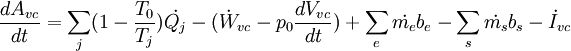
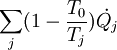 la transferencia de exergía asociada a la transmisión de energía en forma de calor, donde
la transferencia de exergía asociada a la transmisión de energía en forma de calor, donde 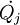 representa la velocidad de transferencia de calor a través de una parte de la frontera a temperatura
representa la velocidad de transferencia de calor a través de una parte de la frontera a temperatura 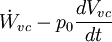 la velocidad de intercambio de exergía por trabajo, excluyendo el trabajo de flujo, más
la velocidad de intercambio de exergía por trabajo, excluyendo el trabajo de flujo, más 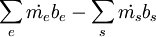 es la transferencia de exergía asociada a la transferencia de masa entre el sistema y el entorno y
es la transferencia de exergía asociada a la transferencia de masa entre el sistema y el entorno y 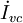 menos la destrucción de exergía por unidad de tiempo causada por irreversibilidades internas del volumen de control.
menos la destrucción de exergía por unidad de tiempo causada por irreversibilidades internas del volumen de control.
