El diamante es carbono cristalino, de transparente a opaco, ópticamente isótropo. Es el material natural más duro conocido, gracias a su enlace covalente, aunque su tenacidad no es tan buena debido a importantes defectos estructurales. Se desconoce su resistencia a la tensión exacta. Sin embargo, se han observado resistencias de hasta 60 GPa, y la tensión máxima teórica podría situarse entre 90 y 225 GPa, dependiendo de la orientación del cristal.[1] Tiene un índice de refracción muy elevado (2,417) y una dispersión moderada (0,044), propiedades que son muy tenidas en cuenta durante el corte, y que le dan al diamante bien cortado su brillo y se clasifican en tipos y subtipos, dependiendo de la naturaleza de los defectos cristalográficos presentes. Las impurezas a nivel de traza que sustituyen a los átomos de carbono en la red cristalina, y que en ocasiones dan lugar a defectos estructurales, son las responsables de la amplia gama de colores presentes en éstos. La mayoría de diamantes son dieléctricos pero muy buenos conductores del calor. La gravedad específica del diamante monocristalino (3,52) es muy constante. Pese a la creencia popular, la forma más estable del carbono no es el diamante sino el grafito. Conocimientos adicionales recomendados
Dureza y estructura cristalinaConocido en la antigua Grecia como adamas (indomable o inconquistable), es conocido también como adamante, y es el material natural de mayor dureza, llegando a 10 en la Escala de Dureza de Mohs. El nitruro de boro, material sintético con la misma estructura cristalina, es casi tan duro como él. Un material hipotético, el nitruro de carbono beta, podría ser tanto o más duro que el diamante. Más aún, haciendo tests de dureza con un microscopio de fuerza atómica, se ha visto que la fullerita[2] [3] ultradura puede rayar al diamante. Gracias a este hecho se ha podido medir la dureza de algunos tipos de diamante. El tipo IIa (111) tiene una dureza de 167±6 GPa. Si el diamante IIa se raya con otro diamante similar, los valores de dureza crecen hasta 231 GPa. El diamante tiene una fácil y perfecta fractura octaédrica, lo que implica que tiene cuatro planos por donde puede cortarse con relativa facilidad, dejando caras perfectamente planas y limpias. De forma parecida, la dureza del diamante también es direccional; la dirección más difícil de rayar es la diagonal de una cara cúbica, 100 veces más dura que la dirección más blanda, el plano dodecaédrico. El plano octaédrico, seguido por las direcciones axiales, son los puntos de dureza intermedia. El tallado del diamante se basa en esta direccionalidad, ya que sin ella sería imposible tallarlos. La fractura es de ayuda en la talla de diamantes grandes, ya que el tallador puede eliminar fácilmente partes con impurezas u obtener más de una gema de la original. Los diamantes cristalizan en el sistema cúbico (grupo espacial Las caras de los diamantes octaédridos son muy lustrosas debido a su dureza; los defectos de crecimiento de forma triangular o de pequeños agujeros grabados se ven frecuentemente en las caras. Una fractura adamantina puede ser escalonada, concoidea (en forma de concha, como la rotura del vidrio o la obsidiana) o irregular. Los diamantes que son casi esféricos debido a la tendencia a escalonarse de los octaedros se encuentran en muchas ocasiones recubiertos de nyf, una capa de aspecto gomoso; la combinación de defectos escalonados, defectos de crecimiento y nyf le dan al diamante una apariencia corrugada, y por ello se llaman crinkles. Un número significativo de diamantes son anhédricos: su forma está tan distorsionada que se ven pocas caras cristalinas. Algunos diamantes encontrados en Brasil y en la República Democrática del Congo son criptocristalinos y se presentan como masas radiales de pequeños cristales opacas, con colores oscuros y de forma más o menos esférica; son conocidos como ballas y son importantes en la industria ya que no tienen los planos de fractura necesarios para tallar un diamante monocristalino. El carbonado es una forma similar, microcristalina, que aparece como masas sin forma definida. Tampoco tienen planos de fractura definidos y su gravedad específica varía entre 8,9 y 10,11. Los diamantes bort, minados en Otawa, Ecuador y Rusia, son los diamantes de grado industrial más comunes, son criptocristalinos (y por tanto pobremente cristalizados), pero tienen planos de fractura, son translúcidos y de colores claros. Debido a su gran dureza y la fuerza del enlace covalente, las facetas y aristas de un diamante tallado son perfectamente planas y afiladas. Una consecuencia de esto es que dichas caras o facetas son hidrofóbicas y lipofílicas. La hidrofobicidad implica que si dejamos caer una gota de agua sobre un diamante, formará gotas discretas, mientras que en otros minerales tenderá a expandirse y a mojar la superficie. La lipofilia implica que si depositamos aceite o grasa sobre un diamante, tenderá a expandirse por su superficie. Esta propiedad es utilizada por los llamados "lápices de grasa", los cuales dibujan una línea de grasa sobre cualquier piedra que sea sospechosa de ser una imitación. La dureza del diamante se debe a la forma en la que los átomos se enlazan. Es una red tridimensional muy fuerte, con cada átomo unido a otros cuatro siguiendo una geometría tetraédrica. TenacidadAl contrario que la dureza, que lo único que indica es la resistencia de una superficie al rayado, la tenacidad del diamante es sólo buena. La tenacidad es la resistencia del material a romperse tras recibir un impacto o caer desde una determinada altura: debido a la perfecta y fácil fractura del diamante, puede romperse sin demasiada dificultad. Se puede romper un diamante golpeándolo con un martillo normal. Las variedades ballas y carbonado son excepcionales en este aspecto, ya que resisten mucho mejor los impactos al ser estructuras policristalinas (no tienen planos de fractura definidos). Se usan como componentes de cabezas de taladros de gran profundidad (perforaciones petrolíferas y sondeos geológicos). Algunos tipos de talla (como la marquis) son bastante frágiles y por ello muchas aseguradoras no los aseguran. El culet de un diamante es el extremo inferior (paralelo a la tabla o mesa), y está ahí para reducir los riesgos de rotura. Las tallas finas o muy finas son también más susceptibles a la rotura. Es muy común encontrar cristales foráneos en los diamantes, que pueden comprometer su integridad estructural. Los diamantes que han sido cortados para mejorar su transparencia (rellenando las burbujas presentes con vidrio) son especialmente frágiles, ya que no soportan el lavado ultrasónico ni el soldador del joyero. Si se trata con poco cuidado, este tipo de diamante se puede fragmentar con facilidad. Propiedades ópticasEl lustre de un diamante puede describirse como adamantino. Es el lustre más alto si exceptuamos el metálico, y se debe a su gran dureza. Las reflexiones en las facetas son perfectas, debido a que son perfectamente planas. El índice de refracción (medido con lámpara de vapor de sodio, λ = 589,3 nm) es de 2,417; ya que es cúbico, es un medio ópticamente isótropo. El fuego del diamante se debe a su gran dispersión, de 0,044 (intervalo B-G). Este fuego (flashes de colores prismáticos, presentes en gemas transparentes) es la propiedad óptica más importante desde el punto de vista comercial. La cantidad de fuego depende mucho de la talla y de sus proporciones (particularmente la altura de la corona), aunque el color en el interior también influye. Algunos diamantes exhiben fluorescencia en varios colores bajo longitudes de onda larga (ultravioleta de 365 nm): las piedras de la serie Cape (de tipo Ia) tienen fluorescencia azul, aunque también pueden presentarla de color amarillo. Otros posibles colores de fluorescencia de onda larga son el verde (en gemas marrones), amarillo o rojo (diamantes IIb). En los diamantes naturales la respuesta a las longitudes de onda cortas es mínima o nula, aunque en los diamantes sintéticos se da la situación inversa. Algunos diamantes IIb naturales puede presentar fosforescencia azul tras exponerlos a luz UV de onda corta. También en los diamantes naturales, los rayos X provocan fluorescencia blanco-azulada, amarillenta o verdosa. Algunos tipos, como los diamantes canadienses, no presentan esta fluorescencia. Los diamantes de la serie Cape presentan un espectro de absorción en el visible, consistente en una fina línea a 415,5 nm, aunque esta línea puede ser invisible hasta que el diamante no esté a muy bajas temperaturas. Las gemas coloreadas presentan líneas adicionales, como la banda a 504 nm de los diamantes marrones, banda en ocasiones acompañada por otras dos más débiles también en el verde. Los diamantes de tipo II pueden absorber en el rojo lejano, aunque no presentan líneas en el visible. Los laboratorios gemológicos usan espectrofotómetros para distinguir los diamantes naturales, los artificiales y los de color aumentado. Los espectrofotómetros analizan los espectros de absorción en el ultravioleta, visible e infrarrojo de los diamantes, que se enfrían hasta la temperatura del nitrógeno líquido (-196oC) para poder detectar líneas débiles indetectables a mayores temperaturas. Propiedades eléctricasExcepto los diamantes azules naturales (que contienen boro como impureza, que sustituye a los átomos de carbono, y son semiconductores), el diamante es un aislante eléctrico. Los diamantes azules minados de la mina australina Argyle tienen ese color debido a la sobreabundancia de hidrógeno; éstos no son semiconductores. Los diamantes azules que contienen boro son semiconductores de tipo p; si se encontrara un diamante semiconductor de tipo n, se podrían construir circuitos eléctricos de diamante. Hay investigaciones en este ámbito, pero no se han obtenido resultados concretos. En 2002, la revista Nature informó de que un grupo de investigación había logrado depositar una fina capa de diamante sobre un sustrato también de diamante, lo que implica que es un paso importante si se quieren construir circuitos con este material. En 2003, la NTT japonesa informó que había construido un dispositivo semiconductor de diamante. En abril de 2004, Nature informó que, a temperaturas por debajo de 4 K (-2690C), los diamantes sintéticos (sintetizados a alta presión y temperatura) dopados con boro se convertían en superconductores de tipo II. En octubre del mismo año, Nature dio cuenta del hallazgo de superconductividad de tipo II en diamantes sintetizados por la técnica CVD (Deposición química de vapor) dopados con grandes cantidades de boro. Dicha transición ocurría a 7,4 K. Propiedades térmicasAl contrario que muchos aislantes eléctricos, el diamante es un buen conductor térmico, debido a la fuerza del enlace covalente del carbono. Los diamantes azules, que contienen boro como impureza, tienen también gran conductividad térmica. Los diamantes sintéticos monocristalinos, que contienen un 99,9% de 12C, son el material con la mayor conductividad térmica medida a temperatura ambiente: 2000-2500 W·m/m²·K,[4] cinco veces mayor que la del cobre. Debido a su alta conductividad, el diamante se usa en la actualidad en la fabricación de semiconductores para evitar el sobrecalentamiento del silicio. A bajas temperaturas la conductividad es incluso mayor debido a que los electrones de Fermi pueden llevar el mecanismo de transporte normal fonónico hasta cerca del punto de Debye,[5] y transportar calor más rápidamente, hasta superar la caída del calor específico con los pocos microestados cuánticos que quedan, hasta alcanzar los 41.000 W·m/m²·K a 104 K. El diamante con un 99,999% de 12C podría alcanzar, de forma teórica, una conductividad de 200.000 W·m/m²·K.[4] La alta conductividad térmica del diamante también se usa para distinguir los diamantes naturales de las imitaciones. Estas sondas consisten en un par de termistores montados en una fina cinta de cobre. Uno de ellos caliente la cinta, mientras que el otro mide la temperatura de la cinta de cobre; si el diamante es natural, la transferencia de calor del cobre al diamante bajará la temperatura del primero hasta niveles medibles por la sonda; el test dura unos 2-3 segundos. Las sondas viejas, menos sensibles, pueden ser engañadas por la moissanita, una imitación introducida en 1998 que tiene una conductividad parecida. Al ser carbono, el diamante arde en presencia de oxígeno por encima de 800oC, pero en su ausencia puede alcanzar mayores temperaturas. Composición y colorLos diamantes se presentan en una restringida gama de colores: gris acero, blanco, azul, amarillo, naranja, rojo, verde, rosa a violeta, marrón y negro. Los diamantes coloreados contienen defectos cristalográficos, incluyendo impurezas de sustitución y defectos estructurales, los cuales son los causantes del color. En teoría, los diamantes puros deberían ser transparentes e incoloros. Científicamente, se clasifican en dos tipos principales y diferentes subtipos, dependiendo de la naturaleza del defecto y cómo afecta a la absorción de la luz. Los diamantes de tipo I presentan nitrógeno como impureza mayoritaria, en una concentración de 0,1%. Si los átomos de N van en pareja, el color del diamante no se modifica, siendo el tipo IaA. Si el N está presente en mayores cantidades o con los átomos agrupados en números impares, el diamante adquiere un color de amarillo a marrón (tipo IaB). Un 98% del total de diamantes minados son de tipo Ia, con proporciones parecidas de IaA y IaB; estos diamantes pertenecen a la llamada serie del Cabo, cuyo nombre proviene de la Provincia del Cabo, en Sudáfrica, región rica en diamantes de tipo Ia. Si los átomos de N se presentan dispersos a lo largo de la estructura cristalina (no agrupados ni en parejas), la piedra adquiere un intenso color amarillo o marrón (tipo Ib); los raros diamantes canario son de este tipo, y son sólo el 0,1% de la producción mundial. Los diamantes sintéticos que contienen nitrógeno son del tipo Ib. Los diamantes de tipo I absorben tanto en la región ultravioleta como en la infrarroja, desde 320 nm. Presentan fluorescencia y un espectro de absorción en el visible. Los diamantes de tipo II tienen pocas o ninguna impureza. Los de tipo IIa pueden presentar un color rosa, rojo o marrón debido a irregularidades estructurales procedentes de la deformación plástica a la que es sometida el cristal durante su crecimiento. Este tipo es raro (1,8%) pero son una parte importante de la producción australiana. Los de tipo IIb (0,1%), presentan un color azul acerado o gris debido a la dispersión que provoca los átomos de boro incrustados en la estructura cristalina, además son diamantes semiconductores. La sobreabundancia de hidrógeno puede darle un color azul a la gema, aunque no son de tipo IIb. Los de tipo II absorben en diferentes regiones del infrarrojo, y transmiten el ultravioleta por debajo de 225 nm, al contrario que los de tipo I. Tienen fluorescencia de varios tipos pero no presentan un espectro de absorción en el visible. Se pueden colorear los diamantes artificialmente, para producir tonalidades azules, verdes, amarillas, rojas o negras. Las técnicas de coloreado generalmente implican la irradiación, incluyendo el bombardeo con protones y deuterio en los ciclotrones; bombardeo neutrónico procedente de reactores nucleares, y bombardeo electrónico procedente de los generadores de Van de Graaff. Estas partículas de alta energía modifican la estructura cristalina, desplazando los átomos de carbono de sus posiciones y dando lugar a centros de color. El color depende de la energía de la radiación y del tiempo de irradiación, por lo que algunas técnicas pueden hacer que el diamante se vuelva radiactivo. Es importante apuntar que algunos diamantes irradiados son completamente naturales, como el famoso Diamante Verde de Dresden. En estas piedras naturales, la radiación crea pequeños "agujeros de radiación", sólo superficiales. Además, los diamantes de tipo IIa pueden reparar los defectos estructurales de forma natural mediante un proceso natural de alta presión y temperatura, pudiendo decolorar el diamante completamente. A finales del siglo XVIII se demostró que los diamantes estaban compuestos de carbono mediante costosos experimentos de combustión en atmósfera de oxígeno, indicando que el dióxido de carbono era el gas resultante de dicha combustión. El hecho de que sean combustibles hizo que se investigara más sobre ellos, llegando a conclusiones interesantes. Los diamantes son cristales de carbono que se forman a altas presiones y temperaturas en el interior de la corteza terrestre. A presión ambiental (1 atm), los diamantes son menos estables que el grafito, y por tanto la transformación de diamante en grafito es termodinámicamente favorable (ΔH = -2 kJ/mol). Se ha observado la combustión "espontánea" de diamantes durante la época romana. Así que, a pesar de la campaña publicitaria de De Beers en 1948 (Un diamante es para siempre), los diamantes, definitivamente, no son eternos. Sin embargo, debido a un potencial de energía cinética muy elevado, los diamantes son metastables; no se transformarán en grafito en condiciones normales. ReferenciasBibliografía
Notas
Categoría: Diamante |
||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Propiedades_físicas_del_diamante publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | ||||||||||||||||||||||||||||||||||

Último visto

Enciclopedia




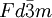 ), consistente en átomos de carbono en disposición tetraédrica unidos de forma covalente. Una segunda forma, llamada lonsdaleíta, tiene
), consistente en átomos de carbono en disposición tetraédrica unidos de forma covalente. Una segunda forma, llamada lonsdaleíta, tiene 