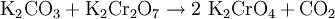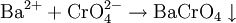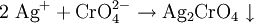Producto destacado
AplicacionesEs utilizado como indicador químico amarillo utilizado para identificar la concentración de ión cloruro en una solución con nitrato de plata. Propiedades físicasEl cromato de potasio es un sólido cristalino de color amarillo limón, muy estable y soluble en agua. Es una sal tóxica y ecotóxica, como muchas sales de cromo. SíntesisEl cromato de potasio se produce haciendo reaccionar carbonato de potasio con dicromato de potasio: ReaccionesEl ión cromato (CrO42-) reacciona con una gran variedad de iones metálicos (Ba2+ Pb2+, Hg22+) uniéndose a ellos y precipitando el respectivo cromato: PrecaucionesEste compuesto es extremadamente tóxico, cancerígeno, puede producir defectos reproductivos en caso de ingestión o inhalación. En el primer caso puede llegar a ser fatal. Además, es un oxidante muy fuerte, por lo que reacciona veloz y violéntamente con muchas sustancias. En contacto con compuestos orgánicos puede reaccionar explosivamente. Referencias1. ^ Potassium chromate information URL last accessed 15 March 2007 Véase también
Categoría: Otras |
|||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Cromato_de_potasio publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | |||||||||||||||||||||||||||||||||||||||||


Enciclopedia