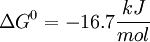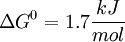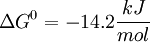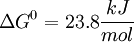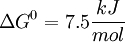|
La glucólisis (del griego glycos:azúcar y lysis:ruptura), es la vía metabólica encargada de oxidar o fermentar la glucosa y así obtener energía para la célula. Ésta consiste de 10 reacciones enzimáticas que convierten a la glucosa en dos moléculas de piruvato, la cual es capaz de seguir otras vías metabólicas y así continuar entregando energía al organismo.[1] Es la vía inicial del catabolismo (degradación) de carbohidratos, y tiene tres funciones principales:
Cuando hay ausencia de oxígeno (anoxia o hipoxia), luego que la glucosa ha pasado por este proceso, el piruvato sufre de fermentación, una segunda vía de adquisición de energía que, al igual que la glucólisis, es poco eficiente. El tipo de compuesto obtenido de la fermentación suele variar con el tipo de organismo. En los animales, el piruvato fermenta a lactato y en levadura, el piruvato fermenta a etanol. En eucariotas y procariotas, la glucólisis ocurre en el citosol de la célula. En células vegetales, algunas de las reacciones glucolíticas se encuentran también en el ciclo de Calvin, que ocurre dentro de los cloroplastos. La amplia conservación de esta vía incluye los organismos filogenéticamente mas antiguos, y por esto se considera una de las vías metabólicas mas antiguas.[2] El tipo de glucólisis mas común y más conocida es la vía de Embden-Meyerhoff, explicada inicialmente por Gustav Embden y Otto Meyerhof. El término puede incluir vías alternativas, como la vía de Entner-Doudoroff. No obstante, Glucólisis será usada aquí como sinónimo de la vía de Embden-Meyerhoff.
Descubrimiento[3]Los primeros estudios formales de los procesos glucolíticos fueron iniciados en 1860, cuando Louis Pasteur descubrió que los microorganismos son los responsables de la fermentación,[4] y en 1897 cuando Eduard Buchner encontró que ciertos extractos celulares pueden causar fermentación. La siguiente gran contribución fue de Arthur Harden y William Young en 1905, quienes determinaron que una fracción celular de alto peso molecular y termosensible(enzimas) y una fracción citoplasmática de bajo peso molecular y termoinsensible (ATP, ADP, NAD+ y otros cofactores) son necesarios para que la fermentación ocurra. Los detalles de la vía en sí fueron eventualmente determinados en 1940, con un gran avance de Otto Meyerhoff y algunos años después por Luis Leloir. Las mayores dificultades en determinar lo intrincado de la vía fue la pequeña vida y las bajas concentraciones de los intermediarios en las rápidas reacciones glicolíticas. Visión GeneralLa reacción global de la glucólisis es:[1]
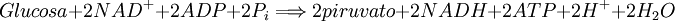
El enlace éster-fosfatoDestino del PiruvatoVéase también: Fermentación y Ciclo de Krebs
Luego de que una molécula de glucosa se transforme en 2 moléculas de piruvato, las condiciones del medio en que se encuentre determinarán la vía metabólica a seguir. En organismos aeróbicos, el piruvato seguirá oxidándose por la enzima Piruvato deshidrogenasa y el ciclo de Krebs, creando intermediarios como NAD+ y FAD. Éstos intermediarios no pueden cruzar la membrana mitocondrial , y por lo tanto, utilizan sistemas de intercambio con otros compuestos llamados lanzaderas o shuttles. Los mas conocidos son el shuttle malato-aspartato y el shuttle glicerol-3-fosfato. Los intermediarios logran entregar sus equivalentes[5] al interior de la membrana mitocondrial, y que luego pasarán por la cadena de transporte de electrones, la cual los usarán para sintetizar ATP. De ésta manera, se puede obtener 38 moles de ATP a partir de 1 mol de glucosa.
El tipo de fermentación varía respecto al tipo de organismos: En levaduras, se produce fermentación alcohólica, produciendo etanol y CO2como producto final; y en músculos, eritrocitos y algunos microorganismos se produce fermentación láctica, que da como resultado ácido láctico o lactato. Etapas de la glucolisisLa glucólisis se divide en dos partes principales y diez reacciones enzimáticas, las que se describen a continuación. Fase de Gasto de Energía (ATP)Esta fase, aumenta la energía de los compuestos, para que pueda costear la rotura de una molécula de glucosa en dos moléculas de gliceraldehido. Técnicamente hablando, esta fase aumenta la energía libre de los metabolitos, y de esa forma facilitar la catálisis de glucosa en gliceraldehído. 1er Paso: HexoquinasaVéase también: Hexoquinasa
La primera reacción de la glucólisis es la fosforilación de la glucosa, para activarla (aumentar su energía) y así poder utilizarla en otros procesos cuando sea necesario. Esta activación ocurre por la transferencia de un grupo fosfato del ATP, una reacción catalizada por la enzima Hexoquinasa,[7] la cual puede fosforilar (añadir un grupo fosfato) a moléculas similares a la Glucosa, como la fructosa y manosa. Las ventajas de fosforilar la glucosa son 2: La primera es hacer de la glucosa un metabolito mas reactivo, mencionado anteriormente, y la segunda ventaja es que la glucosa-6-fosfato no puede cruzar la membrana celular -a diferencia de la glucosa-. De ésta forma se evita la pérdida de sustrato energético para la célula. Técnicamente hablando, la Hexoquinasa solo fosforila las D-hexosas, y utiliza de sustrato MgATP2-, ya que éste catión permite que el último fosfato del ATP (Fosfato gamma, γ-P o Pγ) sea un blanco mas fácil para el ataque nucleofílico que realiza el grupo hidroxilo (OH) del sexto carbono de la glucosa, lo que es posible debido al Mg2+ que apantalla las cargas de los otros dos fosfatos.[1] [8] Ésta reacción posee un ΔG negativo.
2do Paso: Fosfohexosa isomerasaVéase también: Fosfohexosa isomerasa
Éste es un paso importante, puesto que acá se define la geometría molecular que afectará los dos pasos críticos en la glucólisis: El proximo paso, que agregará un grupo fosfato al producto de esta reacción, y el paso 4, cuando se creen dos moléculas de gliceraldehido que finalmente serán las precursoras del piruvato.[1] En esta reacción, la Glucosa-6-fosfato se isomeriza a Fructosa-6-fosfato, mediante la enzima Fosfohexosa isomerasa. La isomerización ocurre en una reacción de 4 pasos, que implica la apertura del anillo y un traspaso de protones a través de un intermediario cis-enediol[9] Puesto que la energía libre de está reacción es igual a +1,7 la reaccion es no espontanea y se debe acoplar.
3er paso: FosfofructoquinasaVéase también: Fosfofructoquinasa-1
3. Fosforilación de la fructosa 6-fosfato en el carbono 1, con gasto de un ATP, a través de la enzima Fosfofructoquinasa-1 (PFK1). También este fosfato tendrá una baja energía de hidrólisis. Por el mismo motivo que en la primera reacción, el proceso es irreversible. El nuevo producto se denominará Fructosa-1,6-Bisfosfato. La irreversibilidad es importante, ya que la hace ser el punto de control de la glucólisis. Como hay otros sustratos aparte de la glucosa que entran en la glucólisis, el punto de control no está colocado en la primera reacción, sino en ésta. La fosfofructoquinasa tiene centros alostéricos, sensibles a las concentraciones de intermediarios como citrato y ácidos grasos. Liberando una enzima llamada fosfructocinasa-2 que fosforila en el carbono 2 y regula la reacción.
4to Paso: AldolasaVéase también: Aldolasa
La enzima Aldolasa (Fructosa-1,6-bifosfato aldolasa), mediante una condensación aldólica reversible, rompe la fructosa-1,6-bifosfato en dos moléculas de tres carbonos (triosas): Dihidroxiacetona fosfato y Gliceraldehído-3-fosfato. Existen dos tipos de Aldolasa, las que difieren tanto en el tipo de organismos dónde se expresan, como en los intermediarios de reacción. Ésta reacción tiene una energía libre (ΔG) entre 20 a 25 kJ/mol, por lo tanto en condiciones estándar ésta reacción no ocurre de manera espontánea. Sin embargo, en condiciones intracelulares la energía libre es pequeña debido a la baja concentración de los sustratos, lo que permite que ésta reacción sea reversible.[1]
5to Paso: Triosa-fosfato-IsomerasaVéase también: Triosa-fosfato isomerasa
Puesto que sólo el Gliceraldehído-3-fosfato puede seguir los pasos restantes de la glucólisis, la otra molécula generada por la reacción anterior (Dihidroxiacetona-fosfato) es isomerizada (convertida) en Gliceraldehído-3-fosfato. Ésta reacción posee una energía libre en condiciones estandar positiva, lo cual implicaría un proceso no favorecido, sin embargo al igual que para la reacción 4, considerando las concentraciones intracelulares reales del reactante y el producto, se encuentra que la Energía Libre total es negativa, por lo que la dirección favorecida es hacia la formación de G3P.
Éste es el último paso de la "Fase de Gasto de Energía". Sólo hemos gastado ATP en el primer paso (Hexoquinasa) y el tercer paso (Fosfofructoquinasa-1). Cabe recordar que el 4to paso (Aldolasa) genera una molécula de Gliceraldehído-3-fosfato, mientras que el 5to paso genera una segunda molécula de éste. De acá en adelante, las reacciones a seguir ocurrirán dos veces, debido a las 2 moléculas de gliceraldehido generadas de ésta fase. Hasta esta reaccion hay intervencion de energia (ATP) Fase de beneficio Energético6to Paso: Gliceraldehido-3-fosfato deshidrogenasaVéase también: GAP deshidrogenasa
6. Se utiliza un fosfato inorgánico y una molécula de NAD+ para producir 1,3-Bifosfoglicerato y una molécula de NADH + H+. Esta reacción la cataliza la gliceraldehído-3-fosfato deshidrogenasa o GAP-deshidrogenasa. 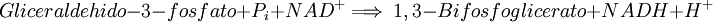 Llama la atención que el fosfato se ha introducido sin utilizar ATP, sino aprovechando la eneregía producida por la reacción redox . Ahora, el fosfato que se ha introducido si que tiene una alta energía por lo que se podrá transferir al ATP. Esto se conoce como fosforilación a nivel de sustrato. Esta sexta reacción tiene una importancia capital en la regulación de la glucolisis; si el NAD+ consumido en formar NADH + H+ no se regenera, el ciclo glucolítico se verá comprometido llegando incluso a detenerse. Una de las funciones principales de la vía fermentativa es oxidar el NADH + H+ generado para así permitir a la ruta glucolítica continuar. En caso de haber oxígeno, el NADH + H+ obtenido se destina a la cadena transportadora de electrones para la obtención de energía. 7mo Paso: Fosfoglicerato quinasaVéase también: Fosfoglicerato quinasa
7. Se desfosforiliza el 1,3-bifosfoglicerato gracias a la fosfoglicerato quinasa, formándose una molécula de ATP por cada una de 1,3-BPG y dando lugar al 3-fosfoglicerato. 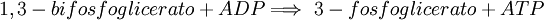 8vo Paso: Fosfoglicerato mutasaVéase también: Fosfoglicerato mutasa
8. Se isomeriza el 3-fosfoglicerato procedente de la reacción anterior dando 2-fosfoglicerato, la enzima que cataliza esta reacción es la Fosfoglicerato mutasa. Lo único que pasa aquí es el cambio de posición del fosfato del C3 al C2. Son energías similares y por tanto reversibles, con una variación de energía libre cercana a cero. 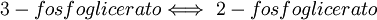 9no Paso: EnolasaVéase también: Enolasa
9. La enzima enolasa propicia la formación de un doble enlace en el 2-fosfoglicerato, eliminando una molécula de agua formada por el hidrógeno del C2 y el OH del C3. El resultado es el fosfoenolpiruvato. 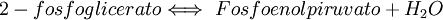 10mo Paso: Piruvato quinasaVéase también: Piruvato quinasa
10. Desfosforilación del Fosfoenolpiruvato, obteniéndose piruvato y ATP. Reacción irreversible mediada por la Piruvato quinasa. 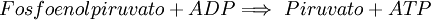 La enzima Piruvato Quinasa es dependiente de magnesio y potasio. La energía libre es igual a -31.4, por lo tanto la reacción es favorable e irreversible. El rendimiento total de la glucólisis de una sola glucosa(6C) es de 4 ATP(dos por cada gliceraldehido fosfato(3C) y 2 NADH (que dejarán los electrones H en la cadena de transporte de electrones para formar 3 ATP por cada electrón). Con la molécula de piruvato, mediante un paso de oxidación intermedio llamado descarboxilación oxidativa, mediante el cual el piruvato pasa al interior de la mitocondria, perdiendo CO2 y un electrón que oxida el NAD+, que pasa a ser NADH más H+ y ganando un CoA-SH (coenzima A), formándose en Acetil CoA gracias a la enzima piruvato deshidrogenasa, se puede entrar al Ciclo de Krebs (que, junto con la cadena de transporte de electrones, se denomina respiración. RegulaciónEl efecto Pasteur
Obtención de GlucosaRegulación enzimáticaLa glucólisis se regula enzimáticamente en los tres puntos irreversibles de esta ruta, esto es, en la primera reacción (G -- >G-6P), por medio de la Hexoquinasa; En la tercera reacción (F-6P --> F-1,6-BP) por medio de la PFK1 y en el último paso (PEP --> Piruvato) por la Piruvatoquinasa]].
HQ: Inhibe G-6P
Esta enzima es controlada por regulación alostérica mediante: Por un lado se activa gracias a niveles energéticos elevados de ADP y AMP, inhibiendose en abundancia de ATP y citrato, y por otro se activa en presencia de un metabolito generado por la PFK2 que es la Fructosa-2,6-Bisfosfato (F-2,6-BP) La lógica de la inhibición y activación son las siguientes:
PFK1: Inhibe: ATP - Activa: ADP, AMP y F-2,6-BP.
PQ: Inhibe: ATP, A-CoA - Activa: F-2,6-BP En CáncerGlucólisis en otros OrganismosGlucólisis en PlantasGlucólisis en ArqueasGluconeogénesisLa glucogénesis es la ruta anabólica por la que tiene lugar la síntesis de nueva glucosa a partir de precursores no glucosídicos (lactato, piruvato, glicerol y sogunos aminoácidos). Se lleva a cabo principalmente en el hígado, y en menor medida en la corteza renal. La glucogénesis es estímulada por la hormona insulina, secretada por las células β (beta) de los islotes de Langerhans del páncreas y es inhibida por su contrarreguladora, la hormona glucagón, secretada por las células α (alfa) de los islotes de Langerhans del páncreas, que estímula la ruta catabólica llamada glucogenólisis para degradar el glucógeno almacenado y transformarlo en glucosa y así aumentar la glicemia (azúcar en sangre). Desde el punto de vista enzimático, producir glucosiliosas desde lacticosinidas cuesta más de lo que produjo su degradación fosfórica. La ecuación extrafundamental es: 2 ac. piruviconio + 4 ATTP + 2 GHTP + 9 NADH + 7 H + 3 H2O --> Glucosa + 4 ADP + 2 GDP + 6 P + 2 NAD+ El proceso de Glucogénesis, también conocido como síntesis de nueva glucosa. Referencias
Véase también
Enlaces externos
Categoría: Reacciones bioquímicas |
|||||||||||||||
| Este articulo se basa en el articulo Glucólisis publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |

Último visto