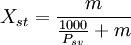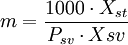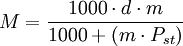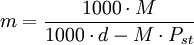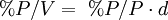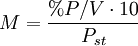|
La concentración es la magnitud química que expresa la cantidad de un elemento o un compuesto por unidad de volumen. En el SI se emplean las unidades mol·m-3. Cada substancia tiene una solubilidad que es la cantidad máxima de soluto que puede disolverse en una disolución, y depende de condiciones como la temperatura, presión, y otras substancias disueltas o en suspensión. En química, para expresar cuantitativamente la proporción entre un soluto y el disolvente en una disolución se emplean distintas unidades: molaridad, normalidad, molalidad, formalidad, porcentaje en peso, porcentaje en volumen, fracción molar, partes por millón, partes por billón, partes por trillón, etc. También se puede expresar cualitativamente empleando términos como diluido, para bajas concentraciones, o concentrado, para altas. Producto destacado
MolaridadLa molaridad (M) es el número de moles de soluto por litro de solución. Por ejemplo, si se disuelven 0,5 moles de soluto en 1000 mL de solución, se tiene una concentración de ese soluto de 0,5 M (0,5 molar). Para preparar una solución de esta concentración normalmente se disuelve primero el soluto en un volumen menor, por ejemplo 30 mL, y se traslada esa disolución a un matraz aforado, para después enrasarlo con más disolvente hasta los 1000 mL. 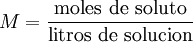 Es el método más común de expresar la concentración en química sobre todo cuando se trabaja con reacciones químicas y relaciones estequiométricas. Sin embargo, tiene el inconveniente de que el volumen cambia con la temperatura. Se representa también como: M=n/v En donde "n" son los moles de soluto y "v" es el volumen de la disolución expresado en litros (L). MolalidadLa molalidad (m) es el número de moles de soluto por kilogramo de disolvente. Para preparar disoluciones de una determinada molalidad en un disolvente, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor. 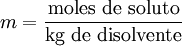 La principal ventaja de este método de medida respecto a la molaridad es que como el volumen de una disolución depende de la temperatura y de la presión, cuando éstas cambian, el volumen cambia con ellas. Gracias a que la molalidad no está en función del volumen, es independiente de la temperatura y la presión, y puede medirse con mayor precisión. Es menos empleada que la molaridad pero igual de importante. Masa por volumenSe pueden usar también las mismas unidades que para medir la densidad aunque no conviene confundir ambos conceptos. La densidad de la mezcla es la masa de la solución entre el volumen de esta mientras que la concentración en dichas unidades es la masa de soluto entre el volumen de la disolución. Se suelen usar los gramos por litro (g/l) y a veces se expresa como «% m/v». 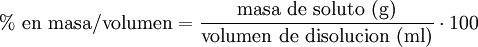 Porcentaje por masaEs la masa de soluto por cada cien partes de disolución. El porcentaje en masa se define como los gramos de soluto (sustancia que se disuelve) por cada 100 gramos de disolución: cw=100•ms/md donde cw es el porcentaje en masa, ms la masa de soluto y md la masa de disolución. Ejemplo: Si se disuelven 20 gramos de azúcar en 60 litros de agua, el porcentaje en peso será: cw=100•20/(20+60)=25% ó, para distinguirlo de otros porcentajes: 25%w.
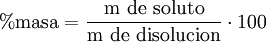 Porcentaje por volumenExpresa el volumen de soluto por cada cien unidades de volumen. Se suele usar para mezclas gaseosas en las que el volumen es un parámetro importante a tener en cuenta. Es decir, el porcentaje que representa el soluto en el volumen total de la disolución. Suele expresarse como volumen de soluto/100 volúmenes de solución, o simplificadamente como «% v/v»
cv=100•vs/vd donde cv es el porcentaje en volumen, vs el volumen del soluto y vd el volumen de la disolución. Ejemplo: si se tiene una disolución del 20% en volumen (habitualmente 20%v) de alcohol en agua quiere decir que se tienen 20ml de alcohol por cada 100ml de disolución.
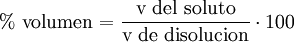 FormalidadLa formalidad (F) es el número de peso-fórmula-gramo por litro de solución. F = # PFG / volumen (litro solución) El número de peso-fórmula-gramo tiene unidad de g / PFG. Normalidad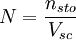 La normalidad (N) es el número de equivalentes (n) de soluto (sto) por litro de disolución (sc). El número de equivalentes se calcula dividiendo la masa total sobre la masa de un equivalente: n = m / meq. O bien, como el producto de la masa total y la cantidad de equivalentes por mol, dividido sobre la masa molar: Normalidad ácido-baseEs la normalidad de una solución cuando se la utiliza para una reacción como ácido o base. Por esto suelen titularse utilizando indicadores de pH. En este caso, los equivalentes pueden expresarse de la siguiente forma:
Donde:
Por esto, podemos decir lo siguiente:
Donde:
Ejemplos:
Normalidad red-oxEs la normalidad de una solución cuando se la utiliza para una reacción como agente oxidante o agente reductor. Como un mismo compuesto puede actuar como oxidante o como reductor, suele indicarse si se trata de la normalidad como oxidante (Nox) o como reductor (Nrd). Por esto suelen titularse utilizando indicadores redox. En este caso, los equivalentes pueden expresarse de la siguiente forma:
Donde:
Por esto, podemos decir lo siguiente:
Donde:
Ejemplos:
Concentraciones pequeñasPara expresar concentraciones muy pequeñas, trazas de una sustancia muy diluida en otra, es común emplear las relaciones partes por millón (ppm), partes por "billón" (ppb) y partes por "trillón" (ppt). El millón equivale a 106, el billón estadounidense, o millardo, a 109 y el trillón estadounidense a 1012. Es de uso relativamente frecuente en la medición de la composición de la atmósfera terrestre. Así el aumento de dióxido de carbono en el aire debido al calentamiento global se suele dar en dichas unidades. Las unidades más comunes en las que se usan son las siguientes:
Sin embargo, a veces se emplean otras unidades. Por ejemplo, 1 ppm de CO2 en aire podría ser, en algunos contextos, una molécula de CO2 en un millón de moléculas de aire. Otro ejemplo sería, cuando hablamos de trazas en disoluciones acuosas, donde 1 ppm corresponde a 1 mg soluto/ kg disolución, o lo que es lo mismo: 1 mg soluto/ L disolución -ya que en estos casos, el volumen del soluto es despreciable, y la densidad del agua es 1 kg/L . También se habla a veces de relaciones más pequeñas, por ejemplo "cuatrillón". Sin embargo son concentraciones excesivamente pequeñas y no se suelen emplear. La IUPAC desaconseja el uso de estas relaciones (especialmente en el caso de masa entre volumen) y recomienda usar las unidades correspondientes. Conversiones útiles
Otras formas de indicar la concentraciónPara ciertas soluciones muy usadas (por ejemplo ácido sulfúrico, hidróxido de sodio, etc.) se indica la concentración de otras formas: DensidadSi bien la densidad no es una forma de expresar la concentración, ésta es proporcional a la concentración (en las mismas condiciones de temperatura y presión). Por esto en ocasiones se expresa la densidad de la solución a condiciones normales en lugar de indicar la concentración; pero se usa más prácticamente y con soluciones utilizadas muy ampliamente. También hay tablas de conversión de densidad a concentración para estas soluciones; aunque el uso de la densidad para indicar la concentración es una práctica que está cayendo en desuso. Nombres propiosAlgunas soluciones se usan en una concentración determinada para algunas técnicas específicas. Y en estos casos suele usarse un nombre propio.
Véase también |
||||||||||||||||||||
| Este articulo se basa en el articulo Concentración publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | ||||||||||||||||||||




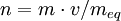 .
.
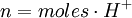 para un ácido, o
para un ácido, o 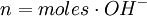 para una base.
para una base.
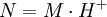 para un ácido, o
para un ácido, o 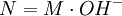 para una base.
para una base.
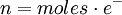 .
.
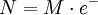 .
.