Hidrógeno verde: ¿Por qué ciertos catalizadores mejoran su funcionamiento?
Interesante descubrimiento
El arseniuro de cobalto cristalino es un catalizador que genera oxígeno durante la división electrolítica del agua en la producción de hidrógeno. Este material se considera un sistema modelo para un importante grupo de catalizadores cuyo rendimiento aumenta bajo ciertas condiciones en el curso de la electrólisis. Ahora, un equipo de HZB dirigido por Marcel Risch ha observado en BESSY II cómo dos mecanismos simultáneos son responsables de ello. La actividad catalítica de cada uno de los centros de catálisis disminuye en el transcurso de la electrólisis, pero al mismo tiempo también cambia la morfología de la capa del catalizador. En condiciones favorables, un número considerablemente mayor de centros de catálisis entra en contacto con el electrolito, por lo que el rendimiento global del catalizador aumenta.
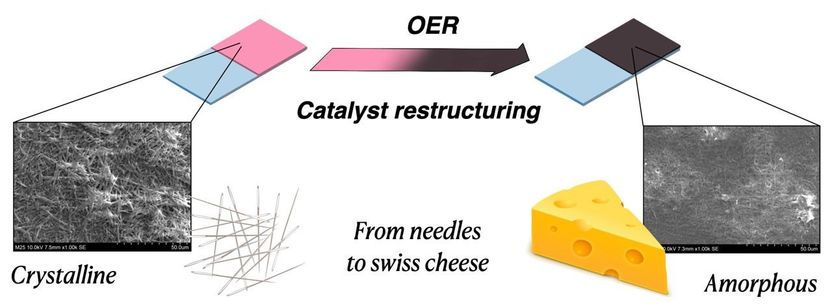
Esquema de la reestructuración electroquímica de la eritrita. La fina estructura en forma de aguja se funde durante la conversión de un material cristalino a uno amorfo, que es poroso como un queso suizo.
© HZB
Por regla general, la mayoría de los materiales de los catalizadores se deterioran durante los ciclos catalíticos repetidos: envejecen. Pero también hay compuestos que aumentan su rendimiento a lo largo de la catálisis. Un ejemplo es el mineral eritrita, un compuesto mineral formado por óxidos de cobalto y arsénico con una fórmula molecular de (Co3(AsO4)2∙8H2O). El mineral destaca por su color púrpura. La eritrita se presta a acelerar la generación de oxígeno en el ánodo durante la división electrolítica del agua en hidrógeno y oxígeno.
Muestras de Costa Rica
El grupo de jóvenes investigadores dirigido por el Dr. Marcel Risch en el HZB, junto con grupos de Costa Rica, ha analizado ahora en detalle estos materiales minerales catalizadores en BESSY II y ha realizado un interesante descubrimiento.
Utilizando muestras producidas por colegas de Costa Rica, consistentes en diminutos cristales de eritrita en forma de polvo, Javier Villalobos, estudiante de doctorado del grupo de Risch en el HZB, recubrió los electrodos con este polvo. A continuación, los examinó antes, durante y después de cientos de ciclos de electrólisis en cuatro electrolitos de pH neutro diferentes, incluida el agua de soda ordinaria (agua carbonatada).
Pérdida de la estructura original
Con el paso del tiempo, la superficie de cada capa catalíticamente activa mostraba claros cambios en todos los electrolitos. La estructura cristalina original se perdió, como muestran las imágenes del microscopio electrónico de barrido, y más iones de cobalto cambiaron su número de oxidación debido al voltaje aplicado, que se determinó electroquímicamente. También se demostró un mayor rendimiento de oxígeno con el tiempo en agua de soda (agua carbonatada), aunque sólo en ese electrolito. El catalizador mejoró claramente.
Observaciones en BESSY II
Gracias a los análisis realizados en BESSY II, los investigadores pueden ahora explicar por qué ocurrió esto: mediante espectroscopia de absorción de rayos X, exploraron el entorno atómico y químico alrededor de los iones de cobalto. Las muestras más activas perdieron su estructura cristalina original de eritrita y se transformaron en una estructura menos ordenada que puede describirse como plaquetas de sólo dos átomos de espesor. Cuanto más grandes eran estas plaquetas, más activa era la muestra. Los datos a lo largo de los ciclos de catálisis mostraron que el número de oxidación del cobalto en estas plaquetas fue el que más aumentó en el agua de soda, de 2,0 a 2,8. Dado que se sabe que los óxidos con un número de oxidación de 3 son muy buenos catalizadores, esto explica la mejora en relación con los catalizadores que se formaron en los otros electrolitos.
Se duplica el rendimiento de oxígeno
En el agua de soda, el rendimiento de oxígeno por ion de cobalto se redujo en un factor de 28 a lo largo de 800 ciclos, pero al mismo tiempo 56 veces más átomos de cobalto cambiaron su número de oxidación electroquímicamente. Macroscópicamente, la generación de corriente eléctrica y, por tanto, el rendimiento de oxígeno del electrodo se duplicaron.
De las agujas al queso suizo
En pocas palabras, Risch explica: "Con el tiempo, el material se convierte en un queso suizo con muchos agujeros y una mayor superficie en la que pueden tener lugar muchas más reacciones. Aunque los centros catalíticos individuales se debiliten un poco con el tiempo, la mayor superficie significa que muchos más centros catalíticos potenciales entran en contacto con el electrolito y aumentan el rendimiento".
Risch sugiere que estos mecanismos también pueden encontrarse en muchas otras clases de materiales formados por compuestos no tóxicos, que pueden convertirse en catalizadores adecuados.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.





































